Halo Sobat Zenius! Kali ini gue mau mengajak elo semua buat ngebahas mengenai materi termokimia kelas 11, mulai dari pengertian, persamaan reaksi, rumus, hingga contoh termokimia dalam kehidupan sehari-hari.
Sebelum masuk ke pembahasan, mungkin Sobat Zenius bertanya-tanya, “apakah termokimia ada hubungannya dengan termodinamika?”
Nah, nggak usah khawatir. Sebab, gue juga akan menjelaskan termokimia dan persamaannya.
Selain itu, gue juga mau ngasih contoh-contoh soal dan pembahasannya supaya bisa elo pelajari nanti.
Yuk, simak rangkuman termokimia kelas 11 dalam artikel ini!
Daftar Isi
Apa Itu Termokimia?
Termokimia adalah ilmu yang mempelajari tentang perubahan panas (kalor) suatu zat yang melibatkan proses kimia dan fisika.
Yap, buat elo yang mengira-ngira ada hubungan apa antara termokimia dan termodinamika, ternyata termokimia ini merupakan bagian dari termodinamika lho, guys.
Di mana termokimia ini menerapkan hukum pertama termodinamika, yaitu mengenai hukum universal dari kekekalan energi dan perpindahan kalor. Berikut adalah bunyi hukum kekekalan energi:
Energi tidak dapat diciptakan atau dimusnahkan, energi hanya dapat berubah dari satu bentuk ke bentuk energi lainnya
Contoh termokimia dalam kehidupan sehari-hari itu apa, sih? Elo bisa lihat penerapan termodinamika pada proses pembakaran atau dalam proses perubahan energi di dalam tubuh.
Selain itu, masih ada contoh lainnya, lho, yang bisa elo temukan! Sebelum membahas lebih lanjut, gue punya kabar gembira buat elo, nih!
Aplikasi Zenius bisa di-download secara gratis dari handphone elo! Lewat aplikasi, Sobat Zenius bakalan menemukan fitur-fitur menarik, seperti ribuah contoh soal dan pembahasan, simulasi ujian try out, hingga adu asah otak dengan siswa lain melalui ZenCore.
Tunggu apa lagi? Download aplikasinya sekarang, yuk!
Kalorimeter
Untuk menentukan kalor reaksi, elo bisa menggunakan alat ukur yang bernama kalorimeter. Kalorimeter merupakan sistem yang di mana tidak ada perpindahan materi dan energi dengan lingkungan di luar kalorimeter tersebut.
Nah, kalorimeter ini ada dua jenis, yaitu kalorimeter bom dan sederhana.
Kalorimeter bom adalah alat yang digunakan untuk mengukur jumlah kalor yang dilepaskan saat pembakaran sempurna.
Sedangkan, kalorimeter sederhana dapat dibuat dari wadah atau gelas yang sifatnya isolator (tidak menghantarkan panas).
Rumus kalorimeter bom:
qreaksi = – (qkalorimeter + qair)
qkalorimeter = Ckalorimeter x ∆T
Keterangan: Ckalorimeter= kapasitas kalor pada kalorimeter (J°C-1 atau JK-1), dan ∆T = perubahan suhu (°C atau K).
Rumus kalorimeter sederhana:
qreaksi = – (qkalorimeter + qlarutan)
atau
qreaksi = – qlarutan
qreaksi = m x c x ∆T
Keterangan: q = kalor reaksi (J atau KJ), m = massa (g atau kg), c = kalor jenis (J/g°C atau K/kg K), dan ∆T = perubahan suhu (°C atau K).
Persamaan Termokimia
Termokimia melibatkan suatu reaksi kimia, tentu saja kalau ada reaksi kimia berarti ada “reaktan” dan “produk/hasil”.
Sobat Zenius bisa lihat pada reaksi yang terjadi antara gas metana (CH4) dan molekul oksigen (O2), kemudian akan menghasilkan produk berupa gas karbon dioksida (CO2) dan air (H2O).
Pada reaksi tersebut, bisa kita lihat bahwa bahan bakar bergabung dengan oksigen untuk menghasilkan air dan karbon dioksida.
Reaksi itu disebut dengan reaksi pembakaran. Kemudian, ketika bahan bakar (pada reaksi di atas adalah metana) diharapkan dapat melepas panas, maka disebut dengan reaksi eksoterm. Sebaliknya, reaksi yang menyerap panas disebut dengan reaksi endoterm.
Rumus Perubahan Entalpi
Perubahan termokimia erat kaitannya dengan istilah “sistem” dan “lingkungan”. Di mana sistem dianggap sebagai reaktan dan produknya, sedangkan lingkungan adalah segala sesuatu yang di luar reaktan dan produknya.
Di sini juga elo akan mengenal istilah entalpi, yaitu besar energi kimia yang dimiliki suatu zat pada tekanan tetap. Jika elo ditanya seperti ini, “jelaskan bagaimana hukum kekekalan energi dengan entalpi”, maka sejatinya entalpi tidak akan berubah apabila tidak ada energi yang diserap ataupun dilepaskan.
Entalpi dinyatakan dengan huruf H (heat content), dengan satuannya yaitu Joule.
Rumus perubahan entalpi (∆H) adalah sebagai berikut:
∆H = Hproduk – Hreaktan
Dengan catatan: 1) Bila ∆H positif, berarti terdapat energi/kalor yang diserap dari lingkungan ke dalam sistem (reaksi endoterm). 2) Sebaliknya, bila ∆H bernilai negatif, berarti terdapat energi/kalor yang dilepas oleh sistem ke lingkungan (reaksi eksoterm).
Ciri-ciri reaksi endoterm yaitu terjadi penurunan suhu yang menyebabkan suhu lingkungan menjadi dingin.
Sedangkan, ciri-ciri dari reaksi eksoterm adalah terjadi kenaikan suhu, sehingga suhu lingkungan menjadi panas.
Contoh Soal Termokimia dan Pembahasan
Setelah memahami materi mengenai termokimia kelas 11, sekarang kita lanjut ke contoh soal dan pembahasannya yuk!
Elo ikuti langkah-langkahnya ya agar dapat semakin memahami materi ini.
Contoh soal
Di dalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (CH4) dengan oksigen berlebih, sehingga terjadi reaksi sebagai berikut:
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (g)
Ternyata terjadi kenaikan suhu sebesar 1,56°C. Diketahui kapasitas kalor kalorimeter yaitu 958 J/°C, massa air di dalam kalorimeter adalah 1.000 gram dan kalor jenis air 4,18 J/g°C. Tentukan kalor pembakaran gas metana dalam kJ/mol. (Ar C = 12, H = 1).
Pembahasan:
Kalor yang dilepas selama reaksi sama dengan kalor yang diserap oleh air di dalam kalorimeter dan oleh kalorimeter, sehingga dapat dituliskan rumus sbb:
qreaksi = – (qkalorimeter + qair)
qair = mair x cair x ∆T = 1 x 4,18 J/g°C x 1,56 °C = 6.520 J
qkalorimeter = Ckalorimeter x ∆T = 958 J/°C x 1,56°C = 1.494 J
Maka,
qreaksi = – (qkalorimeter + qair) = – (6.520 + 1.494) J = – 8.014 kJ
Jumlah metana yang dibakar adalah 0,16 gram, sehingga jumlah molnya adalah sbb:
Mol CH4=0,16 gram : 16 g/mol = 0,01 mol
Untuk setiap reaksi pembakaran satu mol CH4 akan dilepaskan kalor sebanyak:
qreaksi = – 8.014 kJ : 0,01 mol = – 801,4 kJ/mol
Sehingga, besarnya ∆H = qreaksi= – 801,4 kJ/mol.
Demikian rangkuman termokimia kelas 11 yang bisa elo pelajari secara perlahan-lahan. Semoga setelah membaca artikel ini Sobat Zenius jadi lebih mudah dalam mengerjakan soal-soal.
Nah, buat elo yang mungkin masih kebingungan soal materi termokimia, elo bisa banget, kok, belajar lewat video pembahasan dari tutor Zenius. Lewat video pembelajaran, elo bakal disajikan dengan materi yang menarik beserta contoh soal dan pembahasan yang dijelaskan secara detail.
Elo tinggal klik banner di bawah ini, ya!
Lalu, apabila Sobat Zenius mau mengasah otak dengan mengerjakan beragam contoh soal dari setiap mata pelajaran, elo juga bisa, nih, berlangganan paket Aktiva Zenius!
Melalui paket tersebut, elo akan mendapatkan banyak sekali keuntungan, seperti akses live class, mengikuti live class per minggu, kesempatan mengikuti ujian try out sekolah, hingga masuk ke dalam anggota ZenClub.
Klik banner di bawah ini buat berlangganan dari sekarang!

Baca Juga Artikel Lainnya
Macam-macam Zat, Perubahan Fisika dan Kimia
Originally published: February 22, 2021
Updated by: Maulana Adieb












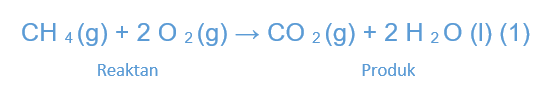

Oksip