Halo Sobat Zenius! Kali ini gue akan membahas mengenai pengertian, penerapan hingga contoh osmosis dalam kehidupan sehari-hari.
Proses osmosis ini akan berkaitan erat dengan proses difusi dan akan elo pelajari pada materi Biologi kelas 11 SMA. Salah satu contoh osmosis dalam kehidupan sehari-hari ada pada tumbuhan.
Pernah gak sih elo memperhatikan bagaimana tumbuhan bisa menyerap air dan menggunakan nutrisi di air untuk bertahan hidup?
Jadi, proses penyerapan air dari dalam tanah ke akar tanaman sebenarnya adalah proses perpindahan molekul air di dalam tanah (berkonsentrasi tinggi) ke dalam akar (konsentrasi rendah).
Daftar Isi
Apa Itu Osmosis? Apa Bedanya dengan Difusi?
Di bagian kali ini, gue akan menjawab pertanyaan apa itu osmosis dan perbedaanya dengan difusi.
Dalam materi osmosis, kadang suka ketuker dengan pengertian difusi. Ini hal yang wajar karena sebutan keduanya mirip-mirip.
Ini juga sering ditemukan karena sebenernya elo membandingkan osmosis dan difusi dari pengertiannya aja tanpa memahami konsepnya.
Oke, gue jelasin satu-satu.
Pengertian difusi adalah perpindahan zat terlarut dari konsentrasi hipertonik ke konsentrasi hipotonik.
Zat terlarut ini contohnya adalah gula, garam, cuka, urea, Natrium Karbonat, dll.
Konsentrasi hipertonik artinya adalah kandungan zat terlarut lebih besar dibandingkan zat pelarut.
Konsentrasi hipotonik berarti kebalikannya, yaitu kandungan zat pelarut (air, alcohol, keton, ammonia, dll) lebih besar dibandingkan dengan zat terlarut.
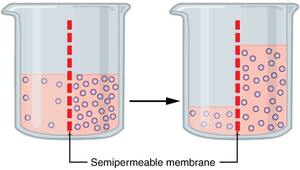
Sedangkan pengertian osmosis adalah perpindahan zat pelarut dari konsentrasi hipertonik ke konsentrasi hipertonik melalui membran semipermeabel.
Membran semi-permeabel adalah penghalang yang hanya akan memungkinkan beberapa molekul melewatinya sambil menghalangi lewatnya molekul lain.
Contohnya akar tanaman yang hanya mengizinkan molekul air yang melewati. Jadi molekul lain, contohnya molekul padat gak bisa melewati membran pada akar.
Dari penjelasan di atas tentang osmosis dan difusi, kira-kira elo udah bisa mengambil kesimpulan dari keduanya gak?
Jadi, intinya difusi adalah perpindahan materi terlarut (gula, garam, cuka, urea, Natrium Karbonat, dll).
Sedangkan pada proses osmosis yang berpindah adalah zat pelarut (air, alcohol, keton, ammonia, dll).
DIFUSI = MATERI TERLARUT (GULA, GARAM, DLL)
OSMOSIS = MATERI PELARUT (AIR, ALKOHOL, DLL)
Dan untuk perpindahan konsentrasinya masih memiliki konsep yang sama. tujuan utama dari perpindahan suatu zat adalah menyamakan konsentrasi antar wilayah sehingga tidak terjadi perbedaan potensial.
Dalam kasus difusi, karena konsentrasi antar wilayah berbeda, sehingga untuk menyamakannya adalah dengan cara perpindahan materi terlarut sehingga konsentrasi antar wilayah menjadi sama.
Sedangkan dalam kasus osmosis, perpindahannya terhalang oleh membran semi-permeabel. Membran ini menghalangi molekul besar seperti glukosa sehingga tidak bisa berpindah ke konsentrasi yang lebih rendah.
Lah terus gimana dong cara biar konsentrasinya sama?
Ya, tinggal pindahin aja materi pelarutnya. Karena materi terlarutnya gak bisa melewati membran semi permeabel, jadi cara untuk menyamakan konsentrasinya adalah dengan perpindahan zat pelarutnya.
Semoga elo paham dan gak ketuker lagi ya perbedaan antara difusi dan osmosis!
Supaya elo makin paham, gue udah ngumpulin contoh difusi dan osmosis dalam kehidupan sehari-hari, daftarnya bisa elo lihat di bawah ini:
Contoh peristiwa difusi dalam kehidupan sehari-hari:
- Bau parfum atau dupa yang menyebar di udara.
- Saat mencelupkan kantong teh ke dalam air panas, sari teh akan menyebar di dalam air.
- Partikel debu kecil atau asap menyebar ke udara dan menyebabkan polusi udara.
- Bernapas dan mengambil oksigen ke dalam tubuh kemudian oksigen berdifusi dalam darah.
- Pembuangan zat limbah dan racun dari tubuh kita.
- Difusi produk limbah, garam dan air pada ginjal di dalam tubuh.
Contoh peristiwa osmosis dalam kehidupan sehari-hari:
- Penyerapan air dari tanah. Proses osmosis terjadi karena akar tanaman memiliki konsentrasi yang lebih tinggi daripada tanah. Oleh karena itu, air mengalir ke dalam akar.
- Jika ikan air tawar atau air asin ditempatkan di air dengan konsentrasi garam yang berbeda, ikan mati karena masuk atau keluarnya air dalam sel-sel ikan.
- Pengawetan makanan menggunakan gula, garam atau cuka juga merupakan contoh osmosis pada kehidupan sehari-hari.
Sel bakteri yang membuat busuk makanan akan kehilangan kadar air karena bertemu dengan konsentrasi zat terlarut yang tinggi sehingga sel bakteri perkembangannya menjadi terhambat. - Manusia yang menderita kolera juga dipengaruhi oleh proses osmosis. Bakteri yang memenuhi usus membalikkan aliran penyerapan dan tidak membiarkan air diserap oleh usus, yang mengakibatkan dehidrasi.
Materi osmosis dan difusi adalah salah satu materi yang sering muncul di Ujian Nasional (UN) mata pelajaran Biologi.
Kalo elo pengen tau daftar materi apa aja yang sering muncul di UN hingga UTBK, elo bisa banget liat daftarnya di Zenius.
Selain kumpulan materi, Zenius juga udah nyiapin contoh soal dan pembahasannya lengkap. Langsung download di bawah ini aja ya!
Rumus Osmosis
Setelah elo memahami pengertian dari osmosis dengan benar, kita bakal belajar cara menghitung tekanan osmotik.
Apa itu tekanan osmotik?
Jadi tekanan osmotik adalah tekanan minimum yang diperlukan untuk mencegah perpindahan pelarut dari larutan murni (encer) kelarutan yang lebih pekat melalui membran semi-permeable.
Dengan kata lain tekanan osmotik adalah tekanan minimum yang mencegah terjadinya osmosis.
Elo juga dapat menghitung tekanan osmotik dalam sebuah larutan menggunakan rumus berikut ini:
π = M×R×T×i
Dimana :
Π = tekanan osmotik larutan (atmosfir)
M = molaritas larutan (mol/L)
R = konstanta gas = 0,08205 L atm mol-1 K-1
T = suhu mutlak (°C + 273) K
i = faktor van ’t Hoff
Rumus ini relatif mudah untuk digunakan karena elo hanya diminta untuk memasukkan angka-angka yang sudah disediakan oleh soal-soal. Biar elo jauh lebih paham, gua bakal kasih contoh soal agar elo jauh lebih paham mengenai konsep osmosis ini!
34,8 gram kalium sulfat (K2SO4) dilarutkan dalam aquades pada suhu 27°C hingga volumenya 900 mL. Tekanan osmotik larutan ini sebesar? (Ar K = 39, S = 32, O = 16)
A. 12,3 atm
B. 16,4 atm
C. 8,2 atm
D. 4,1 atm
Untuk menjawab rumus ini kita harus mengetahui berapa angka dari masing-masing variable sehingga kita bisa langsung menghitung dan mengetahui berapa besar tekanan osmotik dari larutan ini.
Elo sudah mengetahui bahwa R sudah memiliki konstanta yang tetap, yaitu sebesar 0,082, selanjutnya kita mencari suhu, molaritas larutan, dan faktor van’t Hoff nya.
Karena suhu yang diberikan memakai satuan celsius, kita harus mengubahnya menjadi kelvin, yaitu cukup dengan menambahnya dengan 273. Dan langsung dapet deh suhu larutan sebesar 300 Kelvin.
(°C + 273) K
(27°C + 273) K
300 K
Nah untuk mencari molaritas larut, kita harus mengetahui berapa besar massa atom relatif dari masing-masing unsur, karena di soal kita udah dikasih tau berapa besar Ar-nya, kita cukup kalikan dengan jumlah unsurnya terus ditambah deh semuanya
Mr = (2×39)+(32)+(4×16)
= (78)+(32)+(64)
= 174
Akhirnya udah dapet deh masa relatif molekul dari K2SO4 Yakni sebesar 174.
Langsung deh kita cari variabel yang terakhir, yaitu faktor van’t Hoff. Untuk mencari faktor van’t Hoff, kita harus menghitung derajat ionisasi dari suatu senyawa elektrolit. Jika elo dapet soal untuk tekanan osmotik senyawa non elektrolit seperti glukosa, faktor van’t Hoff dapat diabaikan.
(K2SO4) = 2K+ + SO42-
I = N = 3
Nah, akhirnya kita udah dapet deh semua variabelnya, setelah itu kita tinggal masukin deh ke rumus tekanan osmotik di atas.
π = 34,8/174×1000/900×0.082×300×3
π = 16,4 atm
Di awal artikel, gue sempet mention kalau osmosis terjadi pada tumbuhan. Ini juga berkaitan dengan penerapan tekanan osmotik dalam kehidupan sehari-hari.
Beberapa organisme, contohnya tumbuhan yang menggunakan tekanan osmotik untuk memindahkan air.
Tekanan osmotik pada tumbuhan berfungsi untuk kesehatan sel ketika ada terlalu banyak atau terlalu sedikit air di lingkungan ekstraseluler dibandingkan dengan di dalam sel.
Penerapan Osmosis dalam Kehidupan Sehari-hari
Setelah memahami mengenai pengertian osmosis dan rumusnya, selanjutnya di bagian ini gue akan membahas mengenai penerapan tekanan osmotik dalam kehidupan sehari-hari.
Supaya lebih relate, elo pernah gak saat ada ular yang masuk ke rumah, tiba-tiba orang tua atau salah satu kerabat bilang gini:
“Eh ada ular! Cepetan taburi garam biar ularnya gak masuk lagi!”
Biasanya kita manut-manut saja dan langsung menaburi banyak garam di sekitar rumah kita? Tapi pernah gak elo terlintas pertanyaan, Emang ular itu takut sama garam? Emang bakal mati kalau dikasih garam?
Setelah elo paham mengenai konsep osmosis tadi, elo akan tahu bahwa ular takut garam itu adalah HOAX!
Nah, mitos ini sebenernya bisa dijawab dengan konsep penerapan tekanan osmotik dalam kehidupan sehari-hari.
Seperti pengertian yang udah gue jelasin di atas, osmosis merupakan perpindahan zat pelarut dari konsentrasi rendah ke konsentrasi yang lebih tinggi melalui membran semipermeabel.
Ular tidak bisa mati saat diberi garam karena kulit ular sendiri merupakan lapisan sisik yang sangat tebal yang bahkan tidak bisa dilewati oleh air.

Saat ular terkena atau ditaburi oleh garam, air yang ada di dalam tubuh ular tidak bisa berpindah ke luar kulit karena terhalangi oleh sisik meskipun terdapat perbedaan konsentrasi antara keduanya.
Tapi hal ini gak berlaku kalau yang ditaburi garam adalah jenis siput atau jenis cacing.
Siput dan cacing tidak memiliki sisik keras dan bagian luarnya terdiri dari lapisan membran semipermeabel.
Saat elo menaburi siput dan cacing dengan garam, air bisa melewati lapisan tersebut sehingga sel siput dan cacing akan mengalami lisis karena air yang didalamnya “tersedot” oleh perbedaan konsentrasi dari garam.
Jika dibiarkan, sel siput dan cacing akan kering dan berujung pada kematian.

Konsep yang sama juga saat elo menaburkan luka elo dengan garam. Rasa yang amat perih itu disebabkan hancurnya sel karena perbedaan konsentrasi yang diciptakan oleh garam.
“Ah masa sih has, ular mungkin takut garam karena bau/rasanya.”
Kalau seandainya ular takut garam akibat bau/rasanya, tidak ada jenis ular ini di dunia~
Alih-alih dengan garam, ular sebenarnya lebih efektif diusir dengan cairan yang memiliki bau menyengat seperti cuka. Ular memiliki indra pembau dan perasa yang sangat sensitif. Bau cuka yang menyengat akan membuat ular tidak nyaman dan menjauh dari area yang disemprotkan cuka.
Mitos dan miskonsepsi ini masih sangat populer di kalangan masyarakat Indonesia. Namun cukup dengan mempelajari konsep osmosis yang sederhana, elo bisa mematahkan mitos-mitos yang beredar.
Dasar-dasar berpikir ilmiah ini sangatlah penting bagi kita agar tidak mudah percaya dengan isu-isu yang tidak memiliki dasar ilmiah atau saintifik yang jelas.
Gimana? Gampang kan memahami pengertian hingga contoh difusi dan osmosis dalam kehidupan sehari-hari?
Tenang aja, buat elo yang masih bingung dengan materi ini, elo bisa langsung simak penjelasan lengkapnya di sini.
Elo juga bisa klik banner di bawah ini untuk belajar rangkaian materi Biologi dan mata pelajaran penting lainnya. Tinggal klik banner dan ketik materi yang diinginkan di kolom pencarian, elo untuk dapetin soal-soal dan video pembahasannya sekalian lho!
Mungkin itu saja yang bisa gue sampaikan ke elo, semoga setelah membaca tulisan tentang penerapan tekanan osmotik dalam kehidupan sehari-hari ini elo bisa lebih mudah memahami konsep osmosis dan juga penerapannya dalam kehidupan sehari-hari. Sampai jumpa di artikel selanjutnya!
Baca juga Artikel Lainnya Disini:
Siklus Nitrogen: Unsur Terbesar di Atmosfer dan Peranannya Bagi Kehidupan
Larutan Asam: Materi Kimia Kelas 11
Tips Persiapan Belajar UN SMA Kimia
Referensi:
https://en.wikipedia.org/wiki/Osmosis
https://www.zenius.net/prologmateri/kimia/a/1424/tekanan-osmosis
Originally published: September 7, 2021
Updated by: Sabrina Mulia Rhamadanty













Leave a Comment