Pernah dengar istilah larutan elektrolit dan non elektrolit? Elo penasaran gak sih kenapa listrik bisa mengalir di air? Nah, fenomena ini adalah salah satu fenomena yang berhubungan dengan contoh larutan elektrolit.
Atau mungkin elo pernah ngerasain pas rumah kalian kebanjiran, lampu atau listrik rumah kalian justru malah dimatiin sama pihak PLN? Lagi-lagi karena ini berkaitan dengan sifat larutan elektrolit dan non elektrolit.
Ternyata banyak fenomena dalam hidup yang berhubungan dengan larutan elektrolit dan non elektrolit. Tapi apa pengertian larutan elektrolit dan non elektrolit sebenarnya ya?
Jika salah satu alasan mematikan listrik dalam keadaan banjir adalah takut listriknya mengalir di dalam air, lalu sebenarnya apakah semua jenis air atau larutan juga bisa menghantarkan listrik? Gimana kalau air cuka? Air gula? Atau air garam?
Selama ini kita pasti mengira bahwa semua jenis air merupakan konduktor, namun pada tahun 2016 seperti dilansir dari Science Alert, berdasarkan penelitian yang dipimpin oleh Mark Johnson dari Yale University menyatakan bahwa air yang benar-benar murni tidak menghantarkan listrik, dikarenakan kekurangan elektron bebas.
Namun kebanyakan air yang ada di alam kita sudah bercampur dengan berbagai jenis sedimen dan mineral yang kemudian mengionisasi molekul air, dan membuat memungkinkannya untuk menghantarkan listrik. Inilah mengapa air atau H2O adalah salah satu contoh larutan elektrolit lemah.
Selain larutan elektrolit kuat dan elektrolit lemah ternyata ada juga larutan senyawa non elektrolit lho. Apa aja ya contoh larutan elektrolit kuat dan lemah serta larutan non elektrolit?
Daripada bingung, so kuy baca artikel ini sampe abis buat penjelasan lebih detailnya tentang dan non elektrolit!
Daftar Isi
Pengertian Larutan Elektrolit dan Non Elektrolit
Sebelum mengenal jenis-jenis larutan, elo harus bisa menjawab pertanyaan apa pengertian larutan elektrolit dan non elektrolit?
Pertama-tama, arti kata “larutan”, di mana larutan tidak sama dengan air, melainkan merupakan suatu campuran yang bersifat homogen, yang terdiri dari dua atau lebih zat.
Yang dimaksud larutan bersifat homogen adalah larutan memiliki komposisi yang merata atau setiap bagian volumenya akan memiliki komposisi atau sifat yang sama.
Zat yang jumlahnya lebih sedikit disebut zat terlarut atau solut, dan zat yang jumlahnya lebih banyak daripada zat lain disebut pelarut.
Misalnya larutan gula, maka gula merupakan zat terlarut, dan air merupakan pelarut.
Larutan sendiri memiliki banyak jenisnya, di antaranya adalah larutan elektrolit dan larutan non elektrolit yang akan gue bahas lebih lanjut di bawah ini.
Larutan Elektrolit
Pertanyaan apa yang dimaksud larutan elektrolit secara sederhana bisa elo jawab kalo larutan elektrolit adalah larutan yang memiliki partikel-partikel berupa ion-ion yang dapat menghantarkan listrik.
Dari penjelasan singkat di atas, mungkin elo bakal bertanya-tanya, kenapa larutan elektrolit dapat menghantarkan listrik? Arus listrik diteruskan oleh larutan elektrolit dengan mekanisme seperti apa?
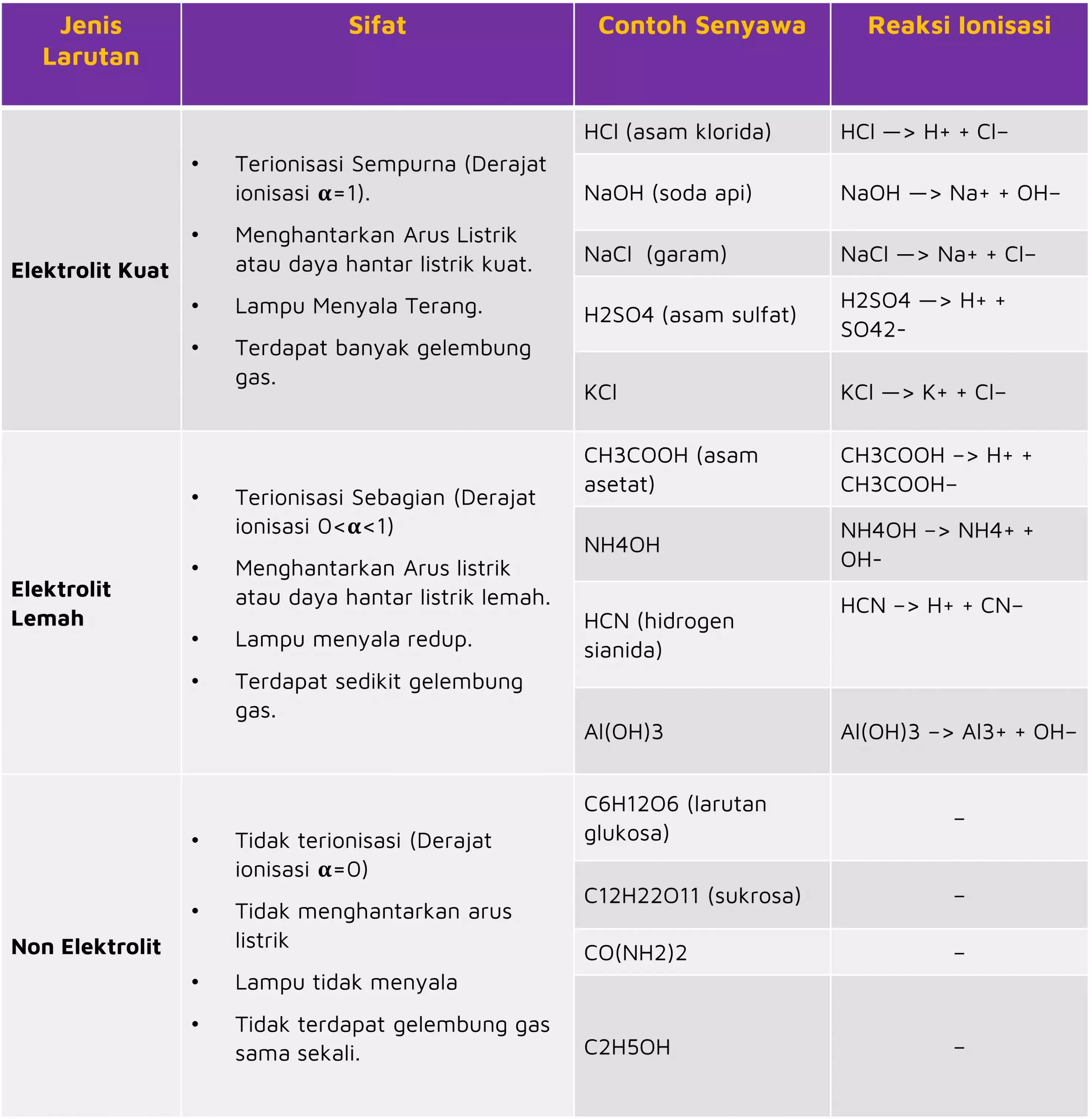
Berdasar proses pembentukan ion-ionnya (ionisasi), larutan elektrolit memiliki dibagi menjadi 2 jenis, yaitu larutan elektrolit kuat dan larutan elektrolit lemah.
- Larutan Elektrolit Kuat adalah larutan elektrolit yang terurai sempurna menjadi ion atau mengalami ionisasi sepenuhnya dalam larutan air atau dalam keadaan lebur.
Karena sifat inilah larutan yang dapat menghantarkan listrik paling baik adalah larutan yang masuk dalam kelompok larutan elektrolit kuat.
Ciri-ciri larutan elektrolit kuat adalah larutan yang sepenuhnya terionisasi untuk membentuk ion bebas ketika dilarutkan, dan tidak ada molekul netral yang terbentuk dalam larutan.
Semakin banyak tersedianya ion bebas dalam suatu elektrolit, semakin besar kapasitasnya untuk membawa atau menghantarkan arus.
Terus apa aja sih contoh larutan elektrolit kuat? Mungkin dari elo ada yang bertanya-tanya kalau garam dapur termasuk elektrolit atau bukan ya?
Jawabannya, garam dapur termasuk elektrolit kuat karena garam memiliki molekul yang dapat terionisasi jika dilarutkan dan akan memberikan larutan tersebut kemampuan untuk menghantarkan listrik.
Garam dapur padat tidak dapat menghantarkan listrik, tetapi ketika garam dilarutkan, ion-ionnya yang dapat bergerak bebas dalam larutan, dan memungkinkan muatan mengalir. Sedangkan, ion-ion garam dalam keadaan padat terikat dengan gaya antar partikel yang kuat. Oleh karena itu, mereka tidak bebas bergerak dalam keadaan padat dan tidak dapat menghantarkan listrik.
NaCl yang dilarutkan dalam air kemudian garam (padatan) larut menjadi ion-ion komponennya, dapat diwakili oleh persamaan ionisasi:
NaCl(s) → Na+(aq) + Cl−(aq)
Perlu elo ingat bahwa larutan elektrolit kuat selalu terdiri dari asam kuat, basa kuat dan garam.
Nah, larutan NaCl (garam) bukan satu-satunya yang tergolong ke dalam larutan elektrolit kuat. Karena terdapat beberapa larutan yang dapat menghantarkan arus listrik adalah NaOH (soda api), H2SO4 (asam sulfat), HCl (asam klorida), dan KCl, yang semuanya juga termasuk elektrolit kuat.
- Larutan Elektrolit Lemah yaitu elektrolit yang tidak terurai sempurna menjadi ion atau mengalami ionisasi sebagian sehingga jumlah zat yang terurai menjadi ion tidak banyak dan menjadi penghantar listrik yang buruk.
Ciri-ciri larutan elektrolit lemah adalah hanya sebagian terionisasi dalam air (biasanya 1% sampai 10%). Karena itu, elektrolit lemah tidak seefisien elektrolit kuat dalam menghantarkan listrik.
Zat-zat dalam larutan elektrolit lemah biasanya meliputi asam lemah dan basa lemah, yang sebagian besar merupakan senyawa kovalen. Beberapa molekul netral hadir dalam larutan elektrolit lemah ini.
Contoh larutan elektrolit lemah adalah CH3COOH (asam asetat), N4OH, HCN (hidrogen sianida), dan Al (OH)3.
Air juga merupakan elektrolit yang sangat lemah. Ionisasi air murni dapat diwakili oleh persamaan ionisasi H2O → H+ + OH-.
Kalo gitu di antara larutan elektrolit kuat dan elektrolit lemah manakah yang dapat menghantarkan listrik lebih baik?
Elektrolit kuat memiliki kecenderungan yang lebih baik untuk memasok ion dibandingkan elektrolit lemah karena pada larutan elektrolit kuat semua senyawa terionisasi menghasilkan ion-ion. Sedangkan pada elektrolit lemah hanya sebagian saja yang terionisasi, sehingga elektrolit kuat merupakan penghantar listrik yang lebih baik.
Larutan Non Elektrolit
Pada pembahasan sebelumnya kita tau kalo larutan yang dapat menghantarkan listrik adalah larutan elektrolit, lalu apa yang dimaksud dengan larutan non elektrolit?
Kebalikan dari larutan elektrolit, larutan non elektrolit merupakan larutan yang tidak dapat menghantarkan listrik karena zat-zat yang dilarutkan tidak menghasilkan ion atau tidak mengalami ionisasi sama sekali.
Contoh larutan non elektrolit adalah Etil alkohol (etanol) karena tidak terionisasi ketika dilarutkan dalam air.
Contoh lain adalah glukosa dalam air membentuk larutan non elektrolit karena meskipun gula larut dalam air, namun gula tetap mempertahankan identitas kimianya.
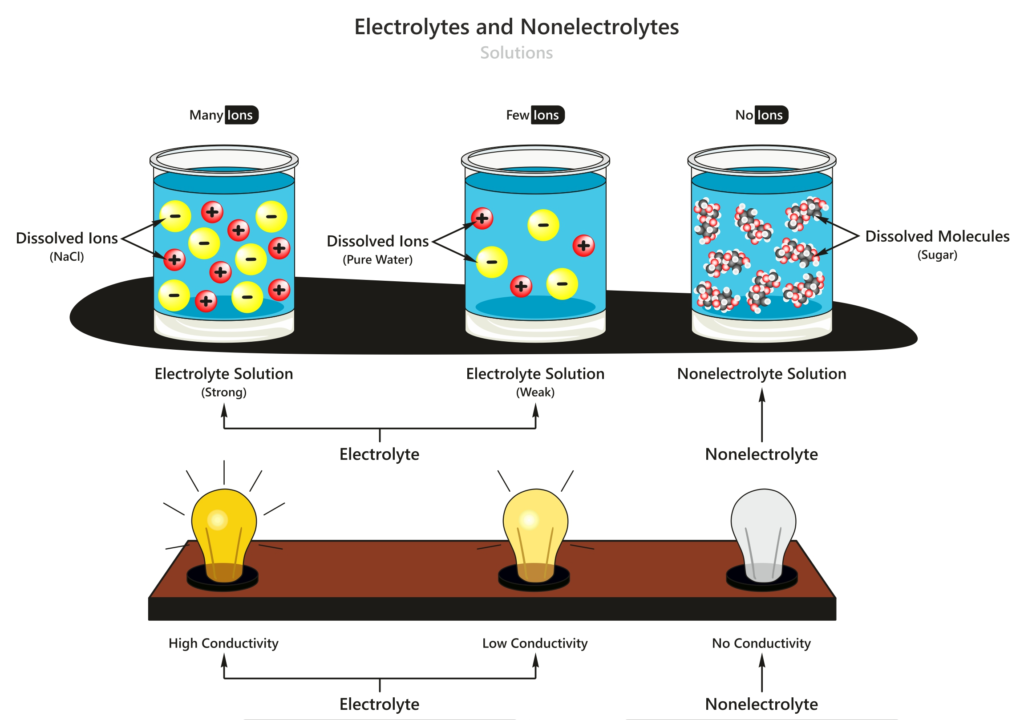
Gambar di atas merupakan salah satu contoh penggambaran perbedaan jumlah molekul ion yang dimiliki oleh elektrolit kuat, elektrolit lemah dan non elektrolit.
Di mana larutan non elektrolit tidak menghasilkan ion-ion yang bergerak bebas sehingga tidak akan menghantarkan listrik, sedangkan pada larutan elektrolit kuat maupun lemah memiliki ion-ion yang bergerak bebas.
Meskipun untuk larutan elektrolit lemah tidak menghasilkan ion sebanyak elektrolit kuat sehingga lampu yang menyala pada elektrolit lemah tidak seterang atau dapat dikatakan menyala redup dibandingkan elektrolit kuat.
Nah, untuk mengetes seberapa paham elo dengan ketiga jenis larutan ini, gue punya satu contoh soal nih yang bisa elo baca lengkap dengan pembahasannya:
Soal Latihan Larutan Elektrolit dan Non Elektrolit:
- Dari kelompok senyawa berikut ini yang dalam larutannya menghantarkan listrik adalah …
- C₁₂H₂₂O₁₁ (Sukrosa)
- H2SO4 (Asam Sulfat)
- CO(NH₂)₂ (Urea)
- NH4OH (Amonium Hidroksida)
- Al2(SO4)3 (Aluminium Sulfat)
- HCN (Hidrogen Sianida)
Untuk menjawab latihan soal yang satu ini elo harus membedah masing-masing senyawa saat terionisasi.
- C₁₂H₂₂O₁₁ adalah nama lain dari sukrosa, senyawa ini tidak mengalami ionisasi sehingga masuk dalam senyawa non-elektrolit dan tidak bisa menghantarkan listrik.
- H2SO4 → 2H+ + SO42- dari hasil ionisasi ini terlihat bahwa asam sulfat terurai sempurna menjadi ion atau mengalami ionisasi sepenuhnya. Asam sulfat juga adalah senyawa asam kuat yang bisa menghantarkan listrik.
- CO(NH₂)₂ adalah nama kimia dari urea, sama seperti sukrosa senyawa ini tidak mengalami ionisasi sehingga masuk dalam senyawa non-elektrolit dan tidak bisa menghantarkan listrik.
- NH4OH → NH4+ + OH- dari hasil ionisasi ini terlihat bahwa amonium hidroksida tidak terurai sempurna menjadi ion, ditambah senyawa ini termasuk basa lemah dengan daya hantar listrik lemah.
- Al2(SO4)3 → 2Al 3+ + 3 SO42- dari hasil ionisasi ini terlihat bahwa Aluminium Sulfat terurai sempurna menjadi ion atau mengalami ionisasi sepenuhnya. Sama seperti garam dapur Aluminium Sulfat adalah kelompok garam yang bisa menghantarkan listrik.
- HCN → H+ + CN– dari hasil ionisasi ini terlihat bahwa Hidrogen Sianida tidak terurai sempurna menjadi ion, ditambah senyawa ini termasuk asam lemah dengan daya hantar listrik lemah.
Jadi jawaban pertanyaan dari kelompok senyawa berikut ini yang dalam larutannya menghantarkan listrik adalah zat yang bisa terionisasi sempurna dan masuk dalam senyawa asam kuat, basa kuat atau garam yaitu: H2SO4 dan Al2(SO4)3.
Untuk mempermudah elo dalam menghafal, berikut ini adalah tabel contoh larutan elektrolit kuat dan lemah serta larutan non-elektrolit:
2. Mengapa larutan elektrolit dapat menghantarkan arus listrik sedangkan larutan non elektrolit tidak?
Kemampuan suatu larutan untuk menghantarkan listrik menunjukkan adanya ion-ion bermuatan listrik yang dapat bergerak bebas di dalam larutan. Sedangkan larutan non elektrolit tidak memiliki kemampuan ini.
Ketika zat yang terionisasi dapat bergerak bebas dalam larutan, memungkinkan muatannya leluasa mengalir, sehingga aliran muatan tersebut sangat ideal sebagai penghantar arus listrik. Inilah alasan mengapa larutan elektrolit disebut sebagai larutan yang dapat menghantarkan arus listrik.
Sedangkan larutan non elektrolit adalah senyawa yang tidak terionisasi sama sekali dalam larutan, tidak terdapat ion-ion di dalam larutan, zat hanya berupa molekul yang tidak bermuatan listrik. Tidak adanya aliran muatan dari pergerakan ion-ion, menyebabkan larutan yang mengandung non elektrolit tidak dapat menghantarkan listrik.
3. Di bawah ini yang dapat menghantarkan listrik paling baik adalah ….
a. Air suling
b. Air laut
c. Air gula
Oke mari kita bahas satu per satu dari ketiga pilihan jawaban di atas.
- Air suling adalah bentuk air murni yang tidak mengandung zat terlarut di dalamnya. Molekul air (H2O) saling berikatan kovalen polar, oleh karena air suling itu tidak dapat menghantarkan listrik karena tidak mengandung ion-ion. Air suling merupakan larutan non elektrolit.
- Di dalam air laut terdapat garam dan garam tersusun atas ion Na+ dan Cl− ion. Ketika garam dicampur dengan air terdapat media pergerakan ion dan memungkinkan terjadinya pergerakan muatan elektron, yang menyebabkan air laut dapat menghantarkan listrik.
- Dalam keadaan terlarut molekul gula dan air tidak mudah terdisosiasi menjadi ion-ion sehingga tidak dapat menghantarkan listrik. Oleh karena itu air gula merupakan larutan non elektrolit.
Jadi jawaban pertanyaan dari pertanyaan di atas adalah air laut dapat menghantarkan listrik paling baik jika dibandingkan dengan air suling dan air gula.
Elektrolit Senyawa Ion dan Kovalen
Berdasarkan dari terbentuknya ikatan ion dalam larutan, senyawa yang termasuk elektrolit adalah senyawa ion dan kovalen polar, sedang untuk senyawa yang termasuk non elektrolit adalah senyawa yang ikatan nya terbentuk dari senyawa kovalen non polar.
Senyawa Ion
Sesuai namanya, senyawa ini terdiri dari ion-ion yang bergerak bebas dalam pelarutnya, contohnya larutan NaCl, dimana terdiri dari ion Na+ dan ion Cl-.
Senyawa NaCl hanya dapat menghantarkan listrik jika dilarutkan atau dilelehkan, sementara jika dalam bentuk kristal atau padatan, NaCl tidak dapat menghantarkan listrik, karena ion tidak dapat bergerak bebas.
Senyawa Kovalen Polar
Senyawa kovalen bersifat polar apabila dilarutkan kedalam air, karena air merupakan pelarut polar. Antara molekul air dan molekul zat terlarut akan terjadi tarik menarik yang cukup kuat untuk memutuskan ikatan-ikatan molekul tertentu, dan membentuk ion.
Sehingga dapat disimpulkan hanya senyawa kovalen polar yang dalam bentuk larutan saja yang dapat menghantarkan listrik, sedangkan yang berbentuk lelehan dan padatan tidak dapat menghantarkan listrik.
Contoh larutan yang termasuk dalam senyawa kovalen polar adalah larutan HCl atau yang biasa disebut larutan asam klorida.
Untuk mempermudah kalian mengingat dan memahaminya, kalian bisa tabel dibawah ini, perbedaan elektrolit pada senyawa ion, kovalen polar, dan kovalen non polar.
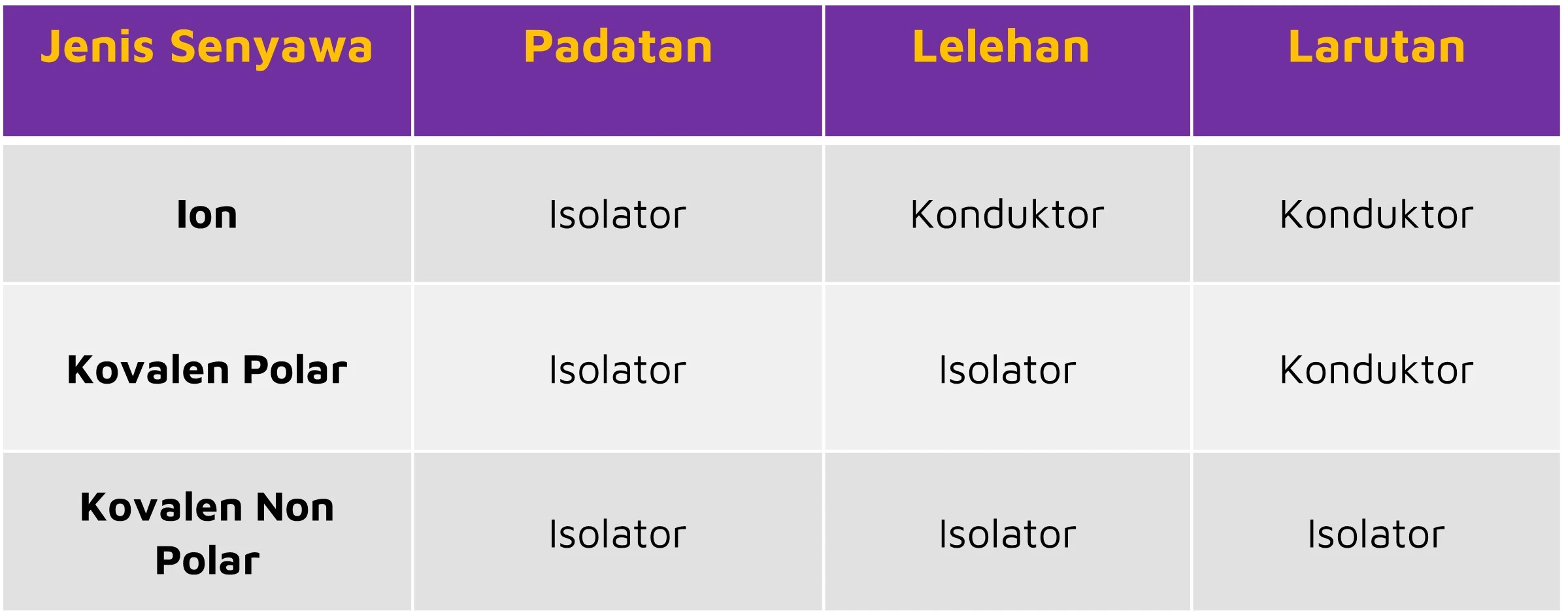
Sumber Tabel: e-modul.kemdikbud.go.id
Derajat Ionisasi
Derajat ionisasi adalah parameter larutan elektrolit yang berupa perbandingan antara jumlah zat yang mengion dengan jumlah zat mula-mula, oleh karena itu digunakan persamaan sebagai berikut
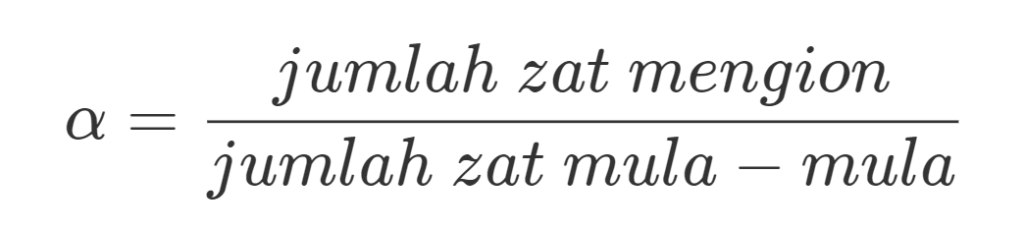
Dimana, 𝛂 = derajat ionisasi.
Dengan ketentuan sebagai berikut,
- 𝛂=1, maka zat mengalami ionisasi sempurna, atau dapat digolongkan asam atau basa kuat.
- 0<𝛂<1, maka zat mengalami ionisasi sebagian, atau dapat digolongkan asam atau basa lemah.
- 𝛂=0, maka tidak mengalami ionisasi sama sekali.
Penerapan Larutan Elektrolit dalam Kehidupan Sehari-hari
Nah, di awal artikel gue udah membahas mengenai pengertian, ciri sehingga contoh larutan elektrolit.
Kalau udah paham sekarang lanjut ke contoh larutan elektrolit dalam kehidupan sehari hari.
Meskipun rasanya terdengar cukup asing di telinga kita, dan jarang dipakai dalam komunikasi sehari-hari, sebenarnya manfaat dari larutan elektrolit maupun non elektrolit banyak diterapkan dalam kehidupan sehari-hari, lho.
Beberapa elektrolit juga memainkan peran penting dalam tubuh. Berikut adalah beberapa manfaat larutan elektrolit:
1. Kalsium dalam tulang dan gigi berperan penting untuk kontraksi otot, pembekuan darah, dan fungsi saraf.
2. Natrium di luar sel terlibat dalam keseimbangan air dan sinyal saraf.
3. Kalium sebagai kation utama di dalam sel. Berperan penting untuk berfungsinya jantung, otot, ginjal, dan saraf.
4. Magnesium dalam tulang dan sel terdapat pada otot, tulang, sistem saraf, dan mengambil bagian dalam banyak reaksi biokimia.
Contoh larutan elektrolit dalam kehidupan sehari hari adalah saat elo melihat iklan minuman penyegar yang berkhasiat untuk menghilangkan dehidrasi. Minuman penyegar itu memang dirancang untuk menyeimbangkan kondisi ion dalam tubuh.
Dehidrasi adalah keadaan di mana tubuh kekurangan cairan, maka kita perlu mengonsumsi cairan atau larutan oralit. Cairan oralit adalah cairan yang terdiri dari air, gula, dan garam, dan biasa dikonsumsi untuk mencegah dehidrasi pada orang yang sedang diare dan muntah.
Tidak hanya itu, contoh larutan elektrolit dalam kehidupan sehari hari juga terkait dengan metabolisme tubuh, seperti sebagai ion pengaktif enzim, melancarkan impuls pada saraf, dan lain-lain.
Selain itu, larutan elektrolit juga banyak digunakan atau diterapkan untuk sel elektrokimia seperti bahan pengisi aki, baterai, dan lain-lain.
Kira-kira kalo disuruh sebutkan peranan larutan elektrolit dalam kehidupan sehari hari elo udah bisa belum?
Nih, supaya gampang menghafalnya udah gue buat daftar contoh larutan elektrolit dalam kehidupan sehari hari di bawah ini:
- Garam meja
Atau NaCl bukan larutan elektrolit biasa, sering digunakan untuk bahan masakan Natrium dan Klorida, adalah elektrolit utama dalam cairan ekstraseluler.
Kadar Natrium dalam tubuh sangat mempengaruhi volume cairan ekstraseluler dan memungkinkan sel saraf dan otot untuk berinteraksi satu sama lain, sedangkan Klorida membantu menjaga tekanan osmotik cairan dalam tubuh.
- Air Laut
Melansir Studious Guy, ada banyak penelitian di seluruh dunia tentang elektrolit air laut yang dapat membantu memetabolisme karbohidrat, protein, dan lemak, serta menjaga fungsi tulang, gigi, dan otot.
Bentuk elektrolit ini memfasilitasi aktivitas cairan tubuh di jaringan untuk menjaga keseimbangan cairan, keseimbangan asam-basa, permeabilitas membran, iritabilitas jaringan (termasuk transmisi saraf dan kontraksi otot).
- Minuman Olahraga
Minuman olahraga dikategorikan menjadi tiga jenis yaitu: Isotonik, Hipertonik, dan Hipotonik.
Minuman olahraga isotonik mengandung konsentrasi garam dan gula yang sama seperti dalam tubuh manusia.
Minuman olahraga hipertonik mengandung konsentrasi garam dan gula yang lebih tinggi daripada tubuh manusia.
Dan minuman olahraga hipotonik mengandung konsentrasi garam dan gula yang lebih rendah daripada tubuh manusia.
- Cuka
Contoh asam yang baik bagi tubuh adalah cuka sari apel yang terdiri dari garam kalium dan magnesium, bersama dengan asam asetat.
Senyawa-senyawa ini akan membantu menyeimbangkan kembali nilai pH aliran darah dengan mengirimkan dosis elektrolit. Ini membuat otot dapat bekerja dengan dan efisien.
- Deterjen
Deterjen adalah senyawa yang meningkatkan sifat pembersihan air dengan menurunkan tegangan permukaannya.
Deterjen hampir mirip dengan sabun tetapi memiliki struktur kimia yang sedikit berbeda.
- Baterai
Baterai adalah perangkat yang terdiri dari kombinasi satu atau lebih sel elektrokimia. Mereka digunakan untuk menyalakan perangkat listrik seperti senter, ponsel, dan mobil listrik.
- Larutan Rehidrasi Oral (ORS)
Oral Rehydration Solutions (ORS) atau cairan oralit, adalah minuman elektrolit yang digunakan untuk mengisi kembali mineral dan cairan pada orang yang menderita dehidrasi, terutama karena diare.
Dibandingkan dengan minuman olahraga, larutan oralit mengandung kalori yang jauh lebih sedikit dan tidak mengandung sukrosa sama sekali, karena sukrosa berpotensi memperburuk diare dengan menarik air ke dalam usus, meningkatkan risiko dehidrasi.
Kalo mau tau penjelasan lebih lanjut mengenai larutan elektrolit dan non elektrolit, elo bisa langsung klik di sini ya.
Biar makin mantap, Zenius punya beberapa paket belajar yang bisa lo pilih sesuai kebutuhan lo. Di sini lo nggak cuman mereview materi aja, tetapi juga ada latihan soal untuk mengukur pemahaman lo. Yuk langsung aja klik banner di bawah ini!
Oke segitu dulu penjelasan gue tentang contoh, ciri ciri larutan elektrolit dan non elektrolit dan kegunaannya dalam kehidupan sehari-hari.
Semoga artikel ini bisa membantu elo dalam memahami materi Kimia kelas 10 ini ya. Selamat belajar!
Baca Juga Artikel Kimia Lainnya
Belajar Strategis Menghadapi UTBK Kimia
Panduan Belajar Soal HOTS Kimia
Referensi:
After Centuries, Scientists Have Finally Figured Out How Water Conducts Electricity – Science Alert (2016)
9 Electrolyte Examples in Daily Life – Studious Guy
Examples of Electrolytes: Basic Explanation and Purpose – Your Dictionary
Strong Electrolytes and Weak Electrolytes Chemistry Tutorial – Ausetute
Electrolytes and Nonelectrolytes – Chemistry LibreTexts (2022)
Unique Features of Aqueous Solutions – Chemistry LibreTexts (2020)
Originally published: February 21, 2021
Updated by: Sabrina Mulia Rhamadanty dan Aulia Rahmah Karunianti (Kampus Merdeka intern)











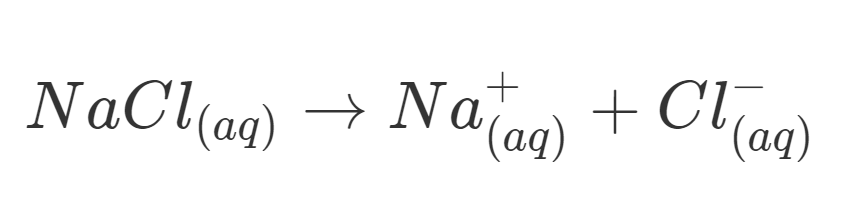
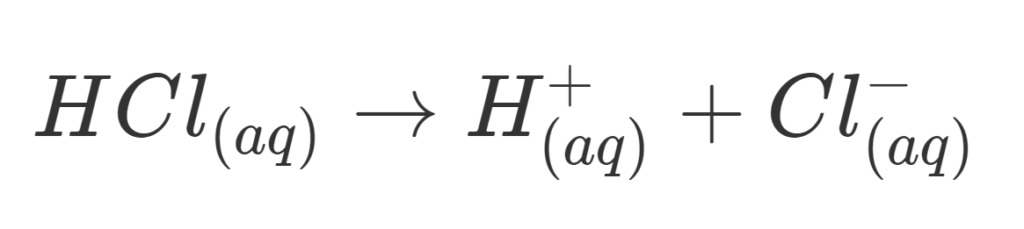


Homework Saver