Hai Sobat Zenius! Di artikel ini gue akan membahas lebih dalam tentang cara menentukan bilangan oksidasi hingga aturan biloks beserta contoh soalnya.
Sebelumnya, elo udah belajar tentang cara menentukan reaksi redoks dan oksidasi. Kalau proses fotosintesis itu merupakan contoh reaksi redoks, di mana ada pengikatan atom H dan pelepasan atom O, sehingga atom H akan bertambah.
Sebaliknya, pada reaksi oksidasi terjadi pengikatan atom O dan pelepasan atom H, sehingga yang akan bertambah adalah atom O.
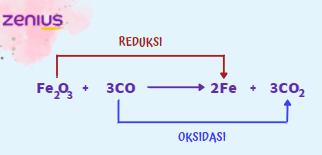
Konsep reaksi reduksi seperti di atas melibatkan perpindahan elektron, jika terjadi pada senyawa ionik aja.
Jadi, nggak terjadi perpindahan pada senyawa kovalen. Sehingga, muncul konsep reaksi reduksi (redoks) yang ketiga, yaitu berdasarkan perubahan pada bilangan oksidasi. Nah, langsung aja kita bahas, yuk!
Baca Juga: Apa Itu Reaksi Redoks dalam Kimia?
Daftar Isi
Apa Itu Bilangan Oksidasi?
Bilangan oksidasi adalah bilangan yang menunjukkan muatan dari setiap jumlah muatan positif atau negatif pada sebuah atom.
Jadi, biloks inilah yang akan menunjukkan jumlah elektron yang sudah diterima atau diberikan oleh suatu atom ke atom yang lain.
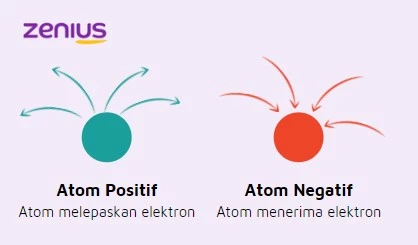
Nah, sekarang pertanyaannya, bagaimana cara kita tahu sebuah atom itu bernilai positif atau negatif?
- Jika suatu atom melepaskan atau memberikan sejumlah elektronnya, maka atom tersebut akan bernilai positif.
- Jika suatu atom menerima sejumlah elektron, maka atom tersebut akan bernilai negatif.
Kenapa, sih, atom harus saling mentransfer elektronnya seperti itu? Jawabannya simpel, yaitu supaya menjadi stabil.
Elo juga nggak suka sebuah kelabilan, kan? Sama, atom juga nggak suka yang labil-labil gitu, mereka lebih suka stabil. Maka dari itu, dicarilah cara supaya mereka bisa menjadi stabil dan ketemu deh dengan cara melakukan reaksi. Paham ya sampai sini?
Eits, kalau udah paham, elo juga bisa, nih, belajar lebih dalam lagi tentang materi ini dan materi Kimia lainnya dengan mudah melalui aplikasi Zenius.
Nggak cuman materi aja, elo juga bakal disuguhkan dengan contoh soal dan pembahasan yang mudah dimengerti, lho!
Dengan begitu, elo bisa mempersiapkan ujian-ujian sekolah dengan maksimal! Jadi, yuk, download aplikasi Zenius dengan klik banner di bawah ini!
Aturan Penentuan Bilangan Oksidasi
Setelah memahami pengertian, Sobat Zenius juga harus tahu aturan biloks. Aturan yang menentukan bilangan oksidasi yang benar adalah:
Unsur Bebas → Biloks = 0
Contoh: Na, K, Cl2, M2, dan O2.
Logam yang Berikatan dengan Unsur Lain → Biloks = Positif
Contoh:
Gol I: Na, K, Rb → biloks = +1
Gol II: Be, Mg, Ca, dan Ba → biloks = +2
Gol III: Al → biloks = +3
Jadi, tergantung golongannya ya, guys.
Ion Tunggal atau Ion Monoatomik → Biloks = Muatannya
Contoh:
Na+ dan K+ → biloks = +1
Ca2+ dan Ba2+ → biloks = +2
Jumlah Biloks Unsur dalam Senyawa atau Biloks Total → Biloks = 0
Contoh: KNO3
(1 x biloks K) + (1 x biloks N) + (3 x biloks O) = 0
Jumlah Biloks Ion Poliatomik → Biloks = Muatannya
Contoh: (SO4)2-
(1 x biloks S) + (4 x biloks O) = -2
Biloks Hidrogen
- Jika hidrogen berikatan dengan logam, maka biloks = -1
Contoh: NaH, hidrogen lebih elektronegatif daripada Na, sehingga hidrogen akan menarik elektron dan Na melepaskan elektron. Maka, H bermuatan negatif dan Na bermuatan positif. H = -1 dan Na = +1.
- Jika hidrogen berikatan dengan non logam, maka biloks = +1
Contoh: HBr, H memiliki elektron 1 dan Br memiliki 7 elektron. Br lebih elektronegatif, sehingga Br akan menarik elektron H, dan H melepaskan elektron. Sehingga, Br bermuatan negatif dan H bermuatan positif → H = +1.
Biloks Oksigen → Biloks = -2
Contoh: H2O, di mana O lebih elektronegatif daripada H, sehingga O akan menerima elektron dari H. Dengan begitu, O = -2.
Kecuali, pada senyawa peroksida dan superoksida.
Biloks Unsur Halogen → Biloks = -1 sampai +7
Contoh:
F (sebagai unsur yang paling elektronegatif) → biloks = -1
Cl, Br, dan I → biloks = variatif (-1, +1, +3, +5, +7)
Selengkapnya bisa elo pelajari pada video belajar Zenius mengenai aturan bilangan oksidasi di sini.
Baca Juga: Rumus Derajat Ionisasi – Materi Kimia Kelas 10
Contoh Soal dan Pembahasan Bilangan Oksidasi
Untuk menguji sejauh mana pemahaman elo mengenai materi di atas, gue ada beberapa contoh soal dan pembahasan yang bisa dijadikan sebagai referensi.
Jadi, elo siapkan alat tulis ya untuk mengerjakan latihan soal di bawah ini!

Contoh Soal 1
Biloks Na dalam NaCl adalah ….
a. 0
b. +1
c. -1
d. +2
e. -2
Jawab: b. +1
Pembahasan: NaCl, keduanya sama-sama memiliki elektron 1. Cl menerima elektron dari Na, sehingga nilai Cl adalah -1. Sedangkan, Na melepaskan elektron, sehingga bernilai +1.
Contoh Soal 2
Dari senyawa H2SO4, tentukan biloksnya!
Jawab: 0.
Pembahasan: H2SO4 merupakan suatu senyawa, kita tahu aturannya bahwa nilai biloks dari suatu senyawa adalah nol. Kalau dirinci akan seperti ini:
(2 x biloks H) + (1 x biloks S) + (4 x biloks O) = (2×1) + (1xbiloks S) + (4x(-2)) = 0
→ 2 + biloks S – 8 = 0
→ biloks S = +6
Itu dia penjelasan singkat mengenai bilangan oksidasi beserta cara menentukan biloks. Semoga setelah membaca artikel ini Sobat Zenius jadi semakin mengerti, ya!
Nah, buat elo yang sekiranya tertarik buat belajar lewat video pembelajaran dari Zen Tutor, elo bisa banget, nih, mengaksesnya lewat website Zenius.
Tinggal klik banner di banner di bawah ini, ya!
Terus, kalau Sobat Zenius mau mempelajari berbagai macam contoh soal dan pembahasan dari setiap mata pelajaran, elo juga bisa, kok, berlangganan paket Aktiva Sekolah Zenius.
Caranya, tinggal klik banner di bawah ini!
Baca Juga: Larutan Elektrolit dan Non Elektrolit – Materi Kimia Kelas 10
Originally published: January 10, 2022
Updated by: Maulana Adieb













Leave a Comment