Halo, Sobat Zenius! Buat elo yang lagi duduk di kelas 10 udah nggak asing ya pasti sama materi bentuk bentuk molekul. Nah, dalam artikel kali ini gue akan mengupasnya lebih dalam lagi, mulai dari pengertian hingga teorinya.
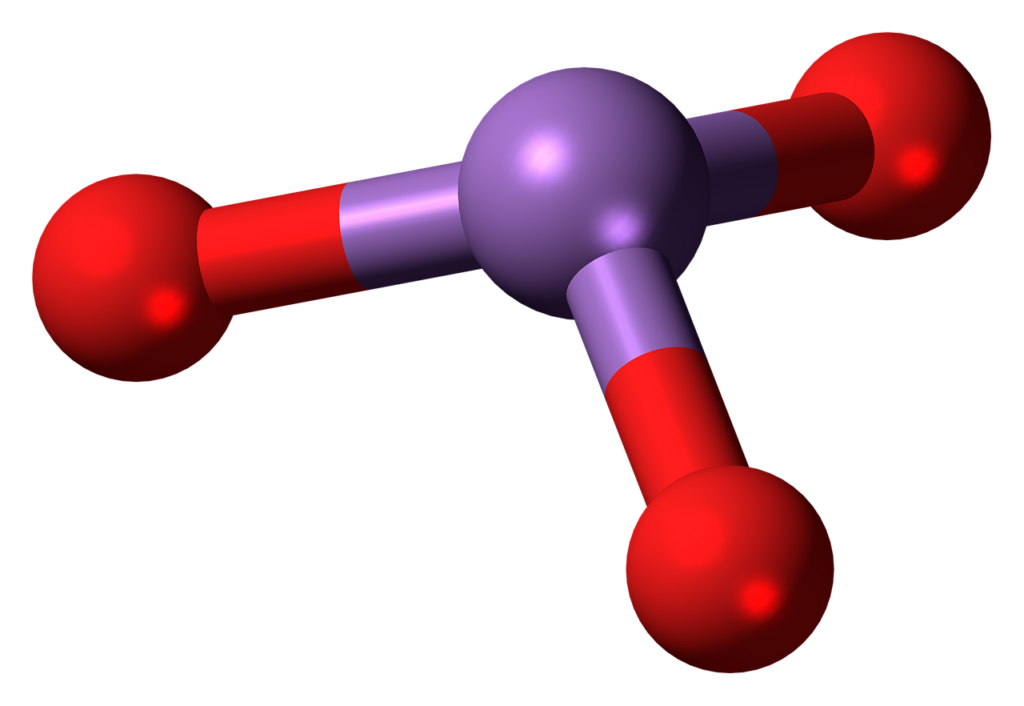
Gue pernah membahas tentang ikatan kimia di artikel sebelumnya. Hayoo.. buat yang belum baca, coba dibaca dulu yuk supaya bisa nyambung bahas materi tentang bentuk molekul kali ini.
Di sana dijelaskan tentang ikatan antar atom yang membentuk suatu molekul kimia. Misalnya, atom Na dan Cl yang akan membuat bentuk molekul NaCl (garam dapur).
Nah, ikatan tersebut ternyata memiliki bentuk yang bervariasi, guys. Salah satu cara untuk meramalkan bentuk tersebut adalah berdasarkan gaya tolak menolak elektrostatik antar pasangan elektron.
Gaya tersebut yang nantinya akan memberikan susunan sedemikian rupa hingga berada pada tingkat energi potensial yang serendah mungkin.
Penasaran? Yuk, simak pengertian serta macam macam bentuk molekul di bawah ini!
Daftar Isi
Apa Itu Bentuk Molekul?
Apakah Sobat Zenius masih ingat pengertian dari molekul? Molekul adalah gabungan dari dua atom atau lebih yang terdapat dalam suatu susunan tertentu dan terikat oleh gaya kimia.
Bentuk geometri molekul bisa bervariasi karena atom-atom yang saling berikatan akan membentuk berbagai senyawa atau molekul yang berbeda-beda supaya bisa stabil.
Bentuk tersebut berdasarkan jumlah pasangan elektron terikat (PEI), pasangan elektron bebas (PEB), dan domain elektron.
Cara mengetahui PEI, PEB dan domain elektron bagaimana? Nah, di sinilah materi ikatan kimia berperan. Kamu ingat dengan struktur lewis pada suatu senyawa?
Yap, struktur lewis adalah langkah awal untuk menentukan geometri molekul. Struktur tersebut menggambarkan keadaan elektron-elektron valensi dari atom yang saling berpasangan dan berikatan secara kovalen.
Nah, sebelum berlanjut ke bentuk-bentuk molekul dan teorinya, gue mau ngasih tahu elo buat download aplikasi Zenius dari sekarang, nih!
Pasalnya, lewat aplikasi elo bakal mendapatkan fitur-fitur menarik buat belajar, seperti ZenBot, ZenCore, hingga simulasi ujian try out.
Yuk, tunggu apa lagi? Download aplikasinya sekarang juga! Gratis!
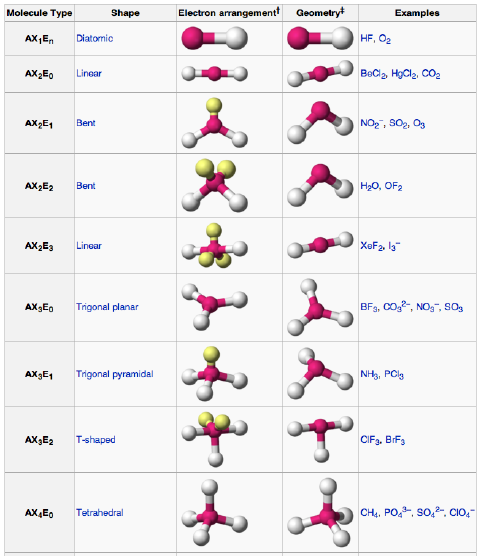
Tipe Bentuk Molekul
Supaya lebih jelas dan kebayang, gue bakal kasih gambaran tentang tipe bentuk molekul. Ini dia varian bentuknya:
Itu dia varian dari geometri molekul, ada linear, trigonal, hingga tetrahedral.
Elo bisa menentukan bentuk suatu molekulnya dari hasil percobaan atau meramalkan bentuk molekul dari struktur elektronnya. Kira-kira lebih mudah menentukan bentuk dengan cara apa?
Teori Bentuk Molekul
Teori yang membahas tentang bentuk suatu molekul ada tiga, yaitu Teori VSEPR (Valence Shell Electron Pair Repulsion), Teori Domain Elektron, dan Teori Hibridisasi.
Wah, seperti ya teori dari ketiganya?
Teori VSEPR
Teori yang pertama adalah VSEPR, yaitu pasangan elektron yang mandiri atau tidak dipakai bersama akan saling tolak menolak.
Pasangan elektron akan cenderung saling berjauhan satu sama lain. Prinsip dari teori ini adalah sebagai berikut:
- Semakin jarak antara kedua pasangan elektron mengecil, maka gaya tolak menolaknya akan semakin kuat.
- Gaya tolakan akan semakin kuat ketika sudut di antara pasangan tersebut membentuk 90 derajat.
- Tolakan yang melibatkan pasangan elektron tunggal akan lebih kuat dibandingkan dengan pasangan ikatan: pasangan mandiri – pasangan mandiri > pasangan mandiri – pasangan ikatan > pasangan ikatan – pasangan ikatan.
Teori Domain Elektron
Bentuk suatu molekul berdasarkan teori domain elektron didasarkan pada jumlah pasangan elektron ikatan dan elektron bebas atau kedudukan suatu elektron.
Sobat Zenius bisa melihat elektron-elektron tersebut dari struktur lewisnya. Prinsip dari teori ini adalah sebagai berikut:
- Antar domain elektron pada atom pusat saling tolak menolak, dengan begitu mereka akan saling mengatur diri dan tolakannya menjadi minimum.
- Kekuatan tolakan dari domain elektron yaitu: PEB – PEB > PEB – PEI > PEI – PEI. Akibat dari adanya perbedaan kekuatan tersebut yaitu mengecilnya sudut ikatan pada bentuk molekulnya.
- Bentuk suatu molekul hanya ditentukan oleh pasangan elektron ikatan (PEI).
Teori domain elektron menggunakan rumus:
AXmEn
Keterangan:
A : atom pusat
Xm : jumlah domain elektron ikatan (PEI)
En : jumlah domain elektron bebas (PEB)
Ada 11 bentuk molekul berdasarkan teori ini, antara lain: linear (AX2), segitiga planar (AX3), segiempat piramida (AX5E), T-shape (Ax3E2), dll.
Teori Hibridisasi
Terakhir, ada teori hibridisasi yang menyatakan bahwa suatu ikatan molekul terjadi akibat terbentuknya orbital hibrida pada sub orbital atomnya.
Dari teori ini muncul 5 bentuk molekul seperti linear (sp), trigonal planar (sp2), tetrahedral (sp3), segitiga bipiramida (sp3d), oktahedral (sp3d2).
Demikian penjelasan mengenai ikatan kimia dan bentuk molekul yang bisa Sobat Zenius pelajari dengan saksama.
Selain belajar lewat artikel, Sobat Zenius juga bisa, lho, belajar lewat video materi pembelajaran yang dibawakan oleh ZenTutor.
Lewat video pembelajaran, elo juga bakal mendapatkan contoh soal dan pembahasan yang lengkap banget!
Yuk, akses segera dengan klik banner di bawah ini!
Selain itu, elo juga bisa belajar banyak hal melalui paket belajar Zenius Aktiva. Dengan berlangganan paket tersebut, elo bisa mengakses ribuan video premium Zenius serta berkesempatan mengikuti ujian try out sekolah.
Menarik, kan? Yuk, segera berlangganan dari sekarang!
Baca Juga Artikel Kimia Lainnya
Originally published: April 22, 2021
Updated by: Maulana Adieb













Leave a Comment