Daya Hantar Listrik dalam Larutan - Materi Kimia Kelas 10

Hai Sobat Zenius, elo masih inget nggak materi tentang kelarutan? Nah, kali ini gue mau ngajak elo buat belajar tentang materi yang masih ada kaitannya dengan materi tersebut, yaitu tentang pengertian dan penggolongan larutan berdasarkan daya hantar listrik. Nggak usah lama-lama lagi, yuk simak penjelasan berikut!
Pengertian Larutan

Pada dasarnya, larutan merupakan sistem homogen yang terdiri dari 2 zat atau lebih, isinya apa sih? Isinya adalah terlarut dan pelarut. Zat terlarut ini pada umumnya jumlahnya lebih sedikit daripada pelarut. Biar elo ada bayangan gue contohin nih misalnya zat pelarutnya adalah air panas, nah zat terlarutnya adalah gula, jadilah larutan gula.
Terus, ternyata bentuknya nggak cuma cair lho, ada juga yang berbentuk gas dan padat. Kalau yang berbentuk gas contohnya adalah campuran dari berbagai gas yang ada. Nah, kalau yang berbentuk padat contohnya adalah emas. Gimana, elo udah ada bayangan dong larutan itu kayak apa?
Jenis Larutan Berdasarkan Daya Hantar Listrik
Oke, kita lanjut ke jenis-jenis larutan berdasarkan daya hantar listriknya.
Berdasarkan daya hantar listriknya, larutan digolongkan menjadi dua jenis, yaitu elektrolit dan nonelektrolit. Perbedaan keduanya adalah ada pada daya hantar listrik di dalamnya.
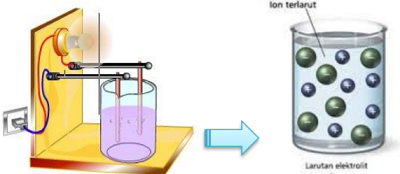
- Larutan elektrolit merupakan larutan yang dapat membentuk ion-ion di dalam proses pelarutannya, dengan begitu larutan tersebut memiliki kemampuan untuk menghantarkan listrik. Contohnya, dalam sebuah percobaan, larutan ini dapat digunakan untuk menyalakan sebuah lampu dan menghasilkan gelembung gas pada elektrodanya.
Senyawa pembentuk elektrolit ini ada dua, yaitu senyawa ion dan senyawa kovalen polar. Senyawa ion merupakan zat elektrolit yang kalau larut dalam air hasilnya adalah ion-ion, contohnya NaCl dan garam lainnya.
Sedangkan, kovalen polar merupakan senyawa yang atom-atomnya bergabung melalui ikatan kovalen. Terbentuknya senyawa kovalen diakibatkan oleh dua atom yang bergabung mempunyai perbedaan keelektronegatifan. Contoh senyawa kovalen polar di antaranya asam klorida, larutan amonia, dan asam cuka murni.
- Larutan non-elektrolit merupakan larutan yang nggak bisa membentuk ion-ion dalam pelarutnya, dengan demikian tentunya nggak bisa menghantarkan listrik. Hal ini dibuktikan dengan suatu percobaan yaitu larutan ini nggak memiliki kemampuan untuk menyalakan lampu dan juga nggak bisa menghasilkan gas pada kedua elektrodenya. Larutan yang demikian disebut non-elektrolit. Senyawa yang termasuk dalam kelompok ini adalah urea, gula (glukosa atau sukrosa), alkohol dan senyawa-senyawa kovalen non polar.

Baca Juga: Larutan Elektrolit dan Non Elektrolit – Materi Kimia Kelas 10
Penggolongan Daya Hantar Listrik Larutan Elektrolit
Nah, Sobat Zenius, sekarang gue mau jelasin ke elo kalau elektrolit dapat digolongkan menjadi dua golongan. Apa aja sih? Jadi kalau berdasarkan kekuatan listriknya, larutan elektrolit digolongkan menjadi elektrolit kuat dan elektrolit lemah. Apa sih bedanya?
- Larutan elektrolit kuat merupakan elektrolit yang punya kekuatan daya hantar listrik besar, yang disebabkan oleh seluruh molekulnya dapat terionisasi dengan sempurna. Larutan ini memiliki nilai α = 1 atau mendekati 1. Terus gimana dong caranya kita untuk mengetahui kalau suatu larutan termasuk ke dalam golongan elektrolit yang kuat?
Ada beberapa ciri yang bisa kita gunakan untuk menandainya, yaitu lampu menyala dengan terang, terdapat banyak gelembung gas, dan persamaan reaksi ditandai dengan satu arah panah ke kanan. Contoh elektrolit kuat adalah asam sulfat (air aki) dan natrium klorida (garam dapur).
- Larutan elektrolit lemah, merupakan elektrolit yang punya kekuatan daya hantar listrik lemah, hal ini disebabkan karena hanya sebagian kecil molekulnya saja yang terurai menjadi ion-ion. Nilai α pada larutan ini berada diantara 0 dan 1 (0 < α < 1). Ciri-cirinya adalah lampu menyala redup atau tidak menyala, gelembung gas relatif sedikit, dan persamaan reaksi ditandai dengan dua arah panah ke kanan dan ke kiri. Contoh elektrolit lemah adalah cuka dapur (CH3COOH), semua jenis air (H2O), amonium hidroksida (NH4OH).
Baca Juga: Pengertian dan Rumus Larutan Penyangga
Contoh Soal dan Pembahasan
Nah, Sobat Zenius, buat ngukur pemahaman elo tentang materi ini, gue akan ngasih contoh soalnya ya!
- Pada saat terjadi banjir, yang biasanya dilakukan adalah mematikan sekring. Hal ini dilakukan agar….
A. Hemat listrik
B. Tidak terbakar
C. Tidak tersengat listrik
D. Tidak meledak
Jawaban: C. Tidak tersengat listrik
Pembahasan: Pada saat banjir, mematikan sekring dilakukan agar tidak ada orang yang tersengat listrik, sebab air banjir dapat menghantarkan arus listrik dari stop kontak atau kabel listrik.
- NaCl padat tidak menghantarkan listrik, sedangkan larutan NaCl dapat menghantarkan listrik. Dari fakta tersebut dapat disimpulkan bahwa ….
Jawaban: NaCl padat tidak terionisasi, tetapi bila dilarutkan dalam air akan terionisasi.
Pembahasan: NaCl padat tidak dapat menghantarkan listrik karena pada kondisi padat tidak terdapat ion-ion yang dapat bergerak bebas. Ketika NaCl dilarutkan dalam air, NaCl akan terionisasi menjadi ion Na+ dan Ion Cl- yang dapat bergerak bebas sehingga larutan dapat menghantarkan listrik.
Gimana nih Sobat Zenius? Udah paham dong sama materi kali ini? Nah, kalau elo mau belajar lagi ni dengan nonton video pembelajaran yang asik, elo bisa langsung aja klik banner di bawah ini ya! Dan jangan lupa buat daftarin akun elo biar nggak ketinggalan informasi menarik lainnya!
Baca Juga: Rumus Empiris dan Rumus Molekul – Materi Kimia Kelas 10