Bilangan Kuantum Utama, Azimut, Magnetik, dan Spin - Materi Kimia Kelas 10

Gimana sih konsep bilangan kuantum utama, azimut, magnetik, dan spin yang dipelajari pada materi Kimia kelas 10? Yuk, kita bahas bersama-sama pada artikel kali ini.
Pada mata pelajaran Kimia kelas 10, tentunya kita mulai mempelajari ilmu kimia dengan lebih dalam, dibanding ketika kita masih duduk di bangku SMP.
Setelah mempelajari pendahuluan ilmu kimia, kita kemudian mempelajari struktur atom. Seluruh benda di dunia ini, mau itu benda hidup maupun benda mati, mau itu zat padat, cair, gas, atau bahkan plasma, semuanya tersusun oleh kumpulan atom yang sangat kecil.

Pada materi struktur atom, kita mempelajari berbagai contoh model atom oleh para ilmuan terdahulu.
Selain itu, kita juga mempelajari bilangan kuantum. Nah, pada artikel kali ini, kita akan membahas bilang kuantum.
Sebelum itu, pastikan elo sudah memahami konsep model atom ya. Elo bisa baca tentang model atom melalui artikel pilihan di bawah ini.
Baca Juga: Teori Mekanika Kuantum dan Modelnya – Materi Kimia Kelas 10
Bilangan Kuantum
Oke, Sobat Zenius sudah tahu kan bagaimana model atom itu? Berdasarkan keterangan dari Britannica (2022), ilustrasi yang menggambarkan atom selama ini sebenarnya masih terus dikembangkan oleh para ilmuan ya.
Umumnya, atom digambarkan memiliki inti berupa proton yang bermuatan positif dan neutron, serta dikelilingi oleh awan elektron bermuatan negatif.
Lantas, apa kaitan antara bilangan kuantum dan atom? Mengapa kita mempelajari sub-materi bilangan kuantum pada materi struktur atom?
Untuk mengetahui itu, coba elo lihat pengertian bilangan kuantum di bawah ini.

Oke, noted. Jadi, bilangan kuantum adalah bilangan yang menyatakan kedudukan atau posisi elektron dalam atom.
Dilansir dari ThoughtCo (2019), nilai dari bilangan ini digunakan ketika mendeskripsikan level energi yang tersedia bagi atom dan molekul.
Sampai sini, sudah mulai kebayang ya apa yang dimaksud dengan bilangan kuantum.
Nah, sebuah elektron pada sebuah atom atau ion memiliki empat bilangan kuantum yang mendeskripsikan kedudukan elektron tadi.
Bagaimana cara menentukan bilangan kuantum itu? Apa saja macam-macam bilangan kuantum? Mari kita bahas macam-macam bilangan kuantum di bagian selanjutnya.
Bilangan Kuantum Utama
Kita mulai dari bilangan kuantum utama (bahasa Inggris: principal quantum numbers) yang dilambangkan dengan “n” ya. Bilangan kuantum utama menyatakan tingkat energi utama elektron suatu atom atau menunjukkan kulit atom.
Kalau Sobat Zenius ingat model atom Bohr, bilangan dengan lambang “n” ini melambangkan kulit atomnya, nih.
Nah, Sobat Zenius, gue punya rekomendasi video materi singkat yang ngebahas soal bilangan kuantum utama, nih. Coba elo klik link di bawah ini ya.
Video: Bilangan Kuantum Utama

Wah, gampang banget ya dipahami. Ternyata, untuk menyatakan tingkat energi utama elektron atau kulit atom pada model atom Bohr, ada beberapa jenis kulit yang seperti kulit K, L, M, N, dan seterusnya.
Nah, K itu melambangkan kulit pertama di mana bilangan kuantum utamanya n=1. Begitu juga kulit lainnya, L (n=2), M (n=3), N (n=4), dan seterusnya.
Yap, nilai bilangan ini harus positif, dan sama dengan atau lebih dari satu. Gak mungkin nilai dari bilangan ini sama dengan nol, atau bahkan negatif.
Anyway, bisa disimpulkan bahwa bilangan ini menunjukkan jarak terjauh antara nukleus dengan elektronnya. Maka, jika nilai n semakin besar, ukuran orbital tentu juga makin besar, begitu juga tingkat energinya.
Nilai n=1 itu menunjukkan kulit elektron paling dalam, yang menunjukkan energi paling rendah dari sebuah elektron.
Bilangan Kuantum Azimut
Bilangan kuantum azimut menyatakan bentuk orbital atau subkulit suatu atom. Dalam bahasa Inggris, bilangan ini disebut sebagai azimuthal quantum number atau orbital angular momentum.
Bilangan kuantum azimut dilambangkan “l” atau “ℓ”, yang nilainya sesuai dengan jumlah momentum sudut orbital.
Nilai dari bilangan ini bisa menunjukkan subkulit s, p, d, atau f yang bermacam-macam.
Dalam penghitungannya, nilai bilangan kuantum azimut ini bergantung pada nilai kuantum utama (n) yang sudah kita bahas tadi.
Maksudnya bagaimana? Yuk, nonton cara menentukan bilangan kuantum azimut melalui rekomendasi video di bawah ini. Selamat menonton!
Video: Bilangan Kuantum Azimut
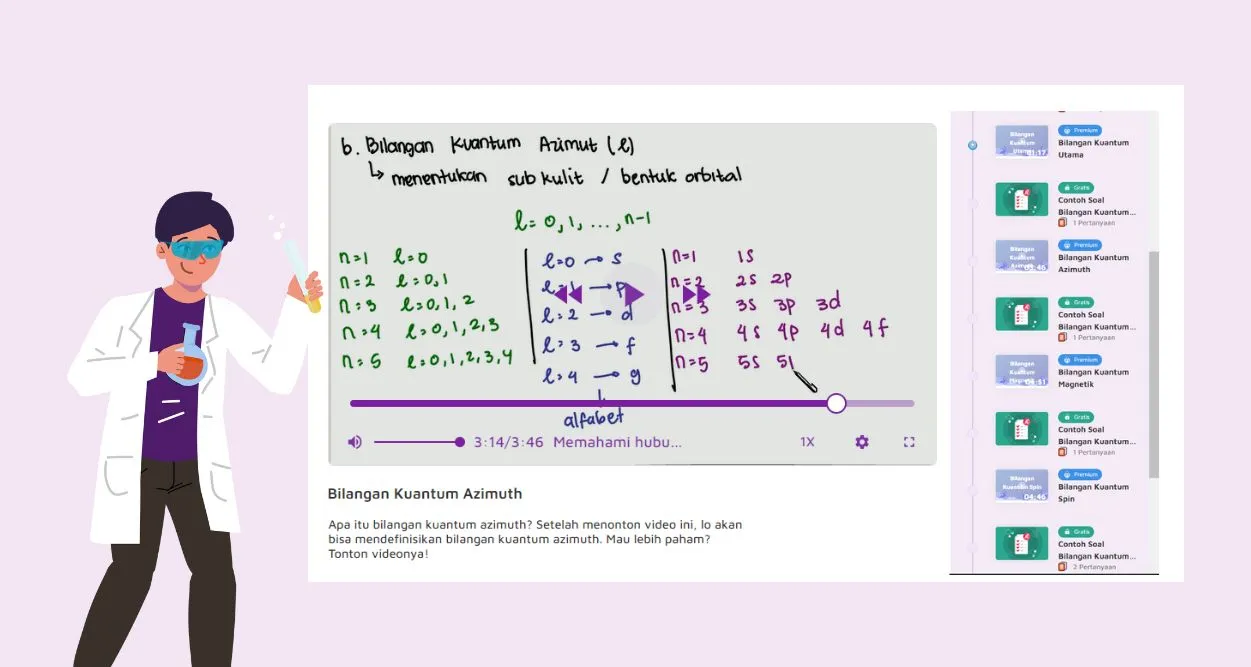
Sudah paham kah konsepnya, Sobat Zenius? Gue coba review sedikit ya. Jadi, bilangan ini memang bergantung pada bilangan kuantum utama.
Contohnnya, jika n=2, maka bilangan kuantum azimutnya adalah 0 dan 1. Sebenarnya, kalau kita lihat kembali, nilai bilangan kuantum azimut itu antara 0 dan (n-1). Semoga ini mempermudah pemahaman Sobat Zenius, ya.
Bilangan Kuantum Magnetik
Bilangan kuantum magnetik menunjukkan orientasi orbital. Bilangan yang dilambangkan “m” ini menyatakan jumlah orbital yang menyusun subkulit dan orientasi dari orbital tersebut.
Sebagai catatan, dalam bahasa Inggris, bilangan kuantum magnetik disebut sebagai magnetic quantum number.
Bilangan kuantum magnetik ini bergantung pada bilangan kuantum azimut, dengan rentang m=-l sampai +l.
Berikut ini video materi Zenius yang menjelaskan contoh bentuk orbital serta penghitungan bilangan kuantum magnetik. Silahkan klik link di bawah ini.
Video: Bilangan Kuantum Magnetik

Mantap, Sobat Zenius. Dari video tersebut, elo bisa melihat cara mencari bilangan kuantum magnetik serta bagaimana bentuk orbitalnya ketika “m” sama dengan 1,3, atau 5 orbital. Tentunya visual tadi mempermudah pemahaman kita ya.
Bilangan Kuantum Spin
Wah, kita sudah sampai ke macam bilangan kuantum yang terakhir nih. Oke, kalau gitu gue mau kasih rekomendasi video yang wajib banget kudu ditonton.
Asli, ini rugi banget kalau elo lewatin. Video ini menjelaskan korelasi percobaan-percobaan yang berkaitan dengan struktur atom, serta kaitannya dengan bilangan kuantum utama, azimut, magnetik, dan spin.
Video: Bilangan Kuantum Spin

Mantap, sekarang kita sudah tahu bahwa bilangan kuantum spin menyatakan arah rotasi elektron dalam orbital.
Yes, ternyata elektron dalam orbital itu berotasi nih, Sobat Zenius. Lantas, bagaimana cara mencari bilangan kuantum spin yang dilambangkan sebagai “s” ini?
Penting untuk diketahui bahwa, bilangan kuantum rotasi elektron ini tidak bergantung sama bilangan kuantum utama, azimut, maupun magnetik tadi ya.
Selain itu, elo juga perlu tahu bahwa nilai “s” itu hanya bisa “– ½” atau “+ ½” saja. Nah, bila nilainya positif, itu menunjukkan bahwa spin arahnya ke atas dan dilambangkan simbol panah ke atas (↑).
Sebaliknya, bila “s” negatif, berarti spin ke arah bawah, dengan lambang panah ke bawah (↓).
Oke Sobat Zenius, kita telah membahas macam-macam bilangan kuantum seperti bilangan kuantum utama, azimut, magnetik, dan spin.
Selanjutnya, kita coba kerjakan contoh soalnya bareng-bareng yuk. Pembahasannya disediakan juga, lho!
Baca Juga: 5 Contoh Model Atom dan Ciri-Cirinya – Materi Kimia Kelas 10
Contoh Soal Bilangan Kuantum
Berikut ini contoh soal dan pembahasannya.
Contoh Soal 1
Bilangan kuantum utama menunjukkan….
A. Kulit atom
B. Bentuk orbital
C. Orientasi/arah
D. Rotasi elektron
E. Bentuk lintasan
Pembahasan
Seperti pembahasan sebelumnya, bilangan kuantum utama itu menyatakan tingkat energi kulit atom ya, Sobat Zenius. Jadi jawaban yang tepat adalah A.
Contoh Soal 2
Bilangan kuantum yang mungkin untuk elektron dalam orbital 1s adalah …
A. n=1, l=1, m=0, s=+½
B. n=1, l=0, m=0, s=+½
C. n=1, l=1, m=0, s=-½
D. n=1, l=1, m=1, s=-½
E. n=1, l=0, m=1, s=-½
Pembahasan
elektron tersebut berada pada kulit pertama (n = 1),
Pada kulit pertama hanya terdapat 1 subkulit s (l = 0)
Pada subkulit s hanya memiliki 1 orbital (m = 0)
Setiap orbital maksimum berisi 2 elektron dengan arah spin yang berbeda (s = +1/2 dan s=-1/2).
Maka, jawaban yang benar adalah B.
Baca Juga: Materi Struktur Atom & Konfigurasi Elektron – Kimia Kelas 10
*********
Oke Sobat Zenius, itulah pembahasan singkat mengenai bilangan kuantum. Kalau elo ingin mempelajari materi Kimia lainnya dengan lebih dalam dan asyik, coba deh nonton video materi Zenius dan akses soal-soalnya.
Pastikan elo log in akun Zenius elo ya supaya bisa akses video dan soalnya.
Kalau Sobat Zenius ingin memperdalam wawasan di materi lainnya, kalian bisa coba dengan berlangganan paket belajar Zenius! Klik gambar di bawah ini ya, dijamin belajar kalian juga bakal makin seru!

Sampai di sini dulu artikel kali ini, dan sampai jumpa di artikel selanjutnya!
Referensi
atom – Britannica (updated 2022)
Teori Mekanika Kuantum dan Modelnya – Materi Kimia Kelas 10 – Zenius Education (2022)
Quantum Number Definition – ThoughtCo (2019)