Mau coba latihan SIMAK UI untuk pelajaran kimia? Yuk, pelajari contoh soal kimia SIMAK UI terlengkap di sini!
Halo, Sobat Zenius! Gimana kabarnya hari ini? Buat elo yang masih belajar buat persiapan ujian masuk perguruan tinggi, tetap semangat, ya!
Nggak terasa waktu berjalan cepat banget, ya? Kayak baru aja kemaren seleksi SNMPTN, sekarang udah ada ujian SBMPTN dan Ujian Mandiri di depan mata. Nah, dari kalian, ada nggak nih yang berniat buat ikut Ujian Mandiri di Universitas Indonesia? Yup, ujian yang dimaksud adalah SIMAK UI.
Kira-kira, tes apa aja ya akan diujikan di SIMAK UI?
Jadi, SIMAK UI tuh terbagi menjadi tiga tes, nih. Semua tes yang akan elo ikuti mempunyai materi yang berbeda, yaitu:
- TKD atau Tes Kemampuan Dasar. Di tes ini, elo akan diuji beberapa materi, seperti Bahasa Indonesia, Bahasa Inggris, dan juga Matematika Dasar.
- TKA atau Tes Kemampuan IPA (Saintek). Tes ini akan disesuaikan dengan jurusan kuliah yang akan elo ambil. Seperti TKA ini, dikhususkan untuk jurusan saintek, materi yang akan diujikan adalah Matematika IPA, Fisika, Kimia, dan juga Biologi.
- TKS atau Tes Kemampuan Sosial. Tes ini di tujukan untuk elo yang mengambil jurusan IPS. materi yang akan diujikan adalah, Ekonomi, Sejarah, Geografi, dan juga Sosiologi.
Nah, sekarang lewat artikel ini gue mau mencoba bantu elo buat membahas sedikit materi yang akan keluar di SIMAK UI nanti. Mata pelajaran yang bakal gue bahas adalah Kimia.
Kimia mungkin jadi salah satu mata pelajaran yang cara belajarnya harus dengan latihan soal setiap hari. Iya nggak sih? Kalau jawabannya iya, artikel ini bakal pas banget buat elo pantengin sampai akhir. Yuk, disimak!
Kenalan dengan Kimia SIMAK UI
Elo tentu sering melihat beberapa kejadian, seperti besi berubah menjadi berkarat, nasi yang basi, susu yang berubah rasa menjadi asam, makanan membusuk, maupun kayu yang terbakar, kan?
Kalau pernah mengalami sendiri, artinya elo sudah secara langsung melihat bagaimana perubahan kimia terjadi. Ada banyak banget fenomena alam yang bisa dikaitkan dengan ilmu kimia.
Mempelajari ilmu kimia ini gak akan jauh dari adanya perubahan bentuk. Saat elo belajar kimia, pasti bakal banyak banget praktek yang mengharuskan elo untuk mengamati bagaimana perubahan bentuk ketika zat A direaksikan dengan zat B. Tentunya kedua zat yang direaksikan tersebut akan menghasilkan zat baru yang berbeda.
Namanya belajar suatu ilmu pasti ada manfaatnya dong? Nah, manfaat mempelajari kimia agar kita bisa mengetahui berbagai perubahan atau proses yang terjadi pada diri kita dan juga sekitar kita. Jangan salah, ternyata tubuh kita juga tidak lepas dari susunan senyawa kimia, seperti oksigen, karbon, kalsium, fosfor, dan masih banyak lagi.
Balik lagi ke pembahasan SIMAK UI. Kira-kira materi kimia yang kayak gimana yang bakal elo temui nanti? Supaya bisa lebih fokus buat belajar mata pelajaran ini, gue bakal kasih bocoran sedikit tentang materi apa aja yang bakal keluar, di antaranya:
- Stoikiometri
- Ikatan kimia
- Termo kimia
- Laju reaksi
- Keseimbangan kimia
- Sel volta
- Reaksi senyawa karbon
- Isomer ruang
- Ikatan kovalen kepolaran
Biar elo makin paham sama materi di atas, elo bisa coba buat cek beberapa contoh soal SIMAK UI yang muncul tahun 2018-2019 sekaligus pembahasannya. Yuk, disimak!
Contoh Soal SIMAK UI Sering Muncul – Kimia
1. Topik: Reaksi Senyawa Karbon
Dari ke lima pernyataan di bawah ini, manakah pernyataan yang tidak benar mengenai reaksi substitusi?
A. Adanya reaksi pertukaran gugus
B. Adanya perubahan ikatan karbon
C. Etanol dapat bereaksi dengan asam klorida membentuk kloroetana
D. Eter dapat bereaksi dengan asam iodida menghasilkan alkohol
E. Ketika alkohol bereaksi dengan logam natrium dihasilkan gas hidrogen
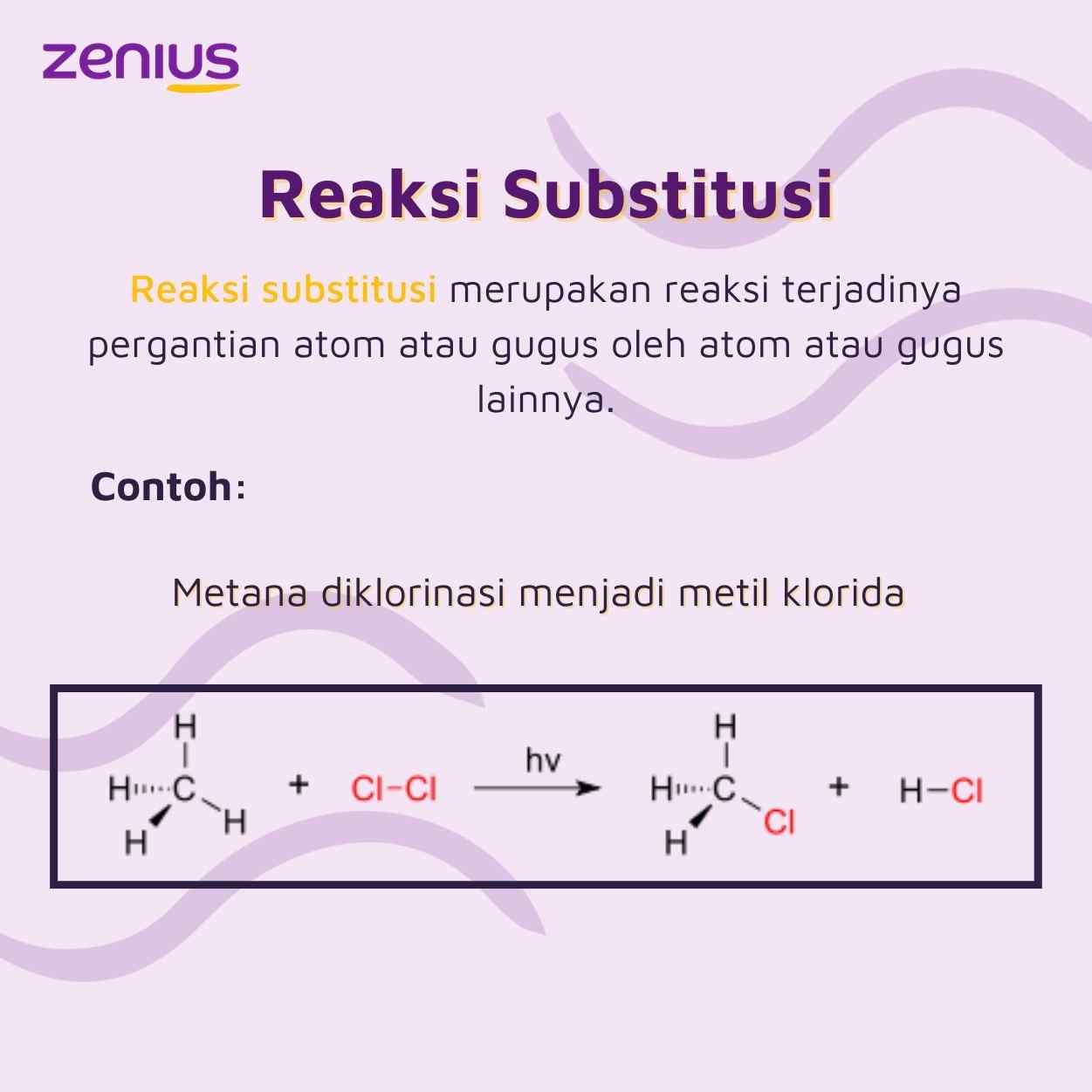
Jawaban: b. Adanya perubahan ikatan karbon
Reaksi substitusi merupakan reaksi terjadinya pertukaran atau pergantian atom atau gugus oleh atom atau gugus yang lain. Contohnya, perubahan Alkohol + Asam Halida, kedua senyawa ini akan membentuk senyawa haloalkana dan juga air.
2. Topik: Laju Reaksi
Terdapat laju reaksi kimia sederhana D E. Laju reaksi umumnya akan terus menurun selama reaksi berlangsung karena….
A. Selama reaksi berlangsung, suhu akan terus menurun
B. Partikel molekul D mengalami banyak tumbukan dengan bertambahnya waktu
C. Tumbukan pada partikel molekul D menurun dengan bertambahnya waktu
D. Dengan bertambahnya waktu, senyawa DE terbentuk
E. Jumlah konsentrasi D dan E menurun dengan bertambahnya waktu
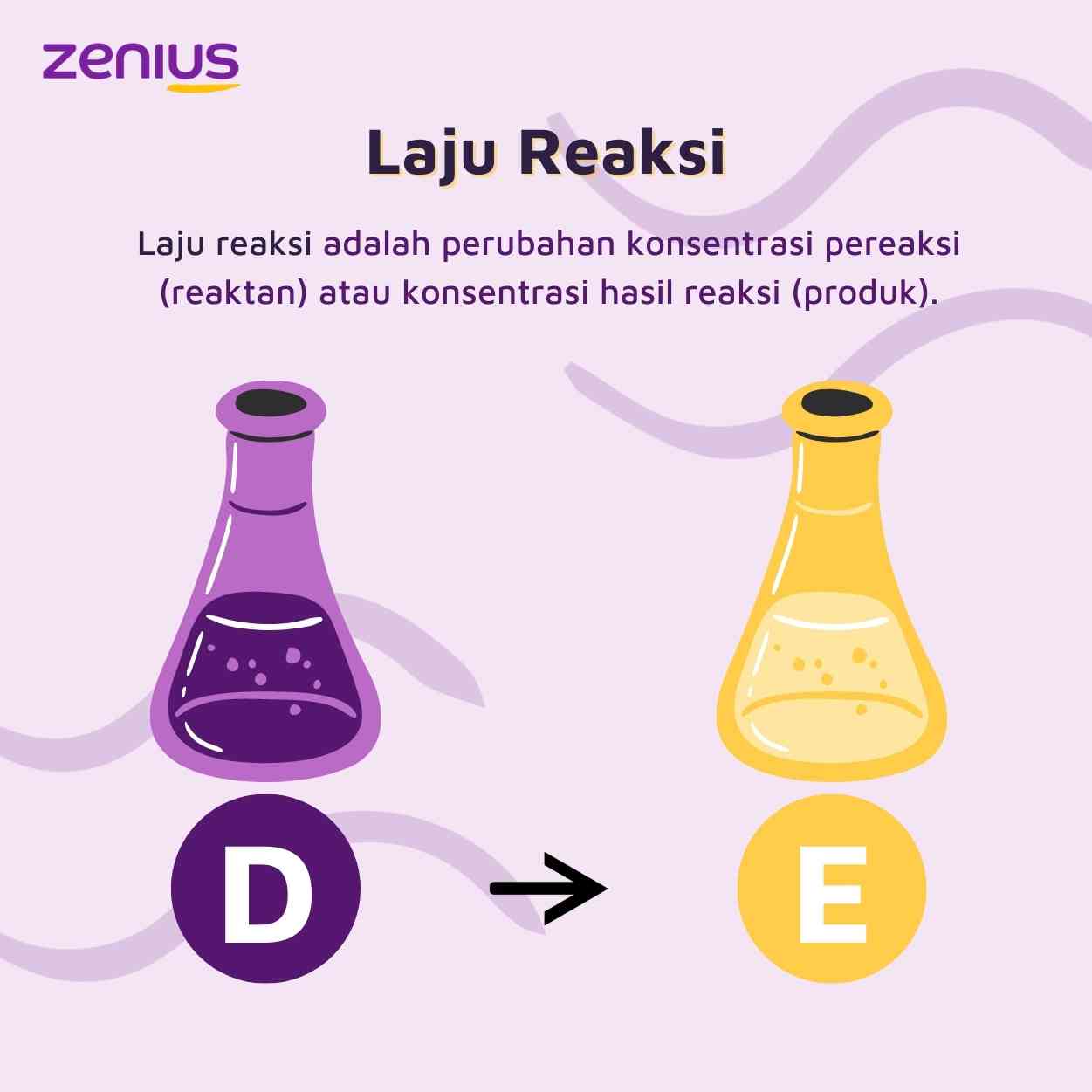
Jawaban: C
Pembahasan:
Laju reaksi memiliki keterkaitan yang erat dengan waktu. Jika laju reaksi kimia terhitung besar maka membutuhkan waktu yang singkat. Sebaliknya, jika laju reaksi kimia kecil, maka waktu yang dibutuhkan akan lebih panjang. Dapat disimpulkan kalau laju berbanding terbalik dengan waktu.
Makanya, jika tumbukan pada partikel molekul D mengecil, maka semakin panjang waktu yang dibutuhkan.
Baca Juga: Gagal SBMPTN & SIMAK UI, Gimana Dong?
3. Topik: Kesetimbangan Kimia
Jika pada suatu reaksi
Reaktan ⇌ Produk
Dengan nilai Kc setimbang yaitu 0,5. Saat terjadi perubahan pada reaksi, nilai Qc yang baru adalah 0,1.
Manakah pernyataan yang tepat di bawah ini?
A. Konsentrasi produk setelah terjadi perubahan menjadi besar
B. Konsentrasi reaktan setelah terjadi perubahan menjadi lebih kecil
C. Konsentrasi produk setelah terjadi perubahan menjadi lebih kecil
D. Konsentrasi reaktan akan bertambah untuk mencapai kesetimbangan
E. Reaksi akan bergeser ke arah kiri agar mencapai keadaan setimbang
Jawaban: C
Pembahasan:
Kalau pada suatu reaktan terjadi Reaktan ⇌ Produk dan terdapat keterangan kesetimbangan Kc = 0,5
Setelah terjadi perubahan, Qc = 0,1
Maka, K = [produk]x/[reaktan]y
Pada saat terjadi perubahan, nilai Qc aka menjadi lebih kecil, yang artinya produk jadi lebih kecil dan reaktan jadi lebih besar.
Supaya bisa mencapai kesetimbangan, reaksi akan bergeser ke produk atau ke sebelah kanan.
Sehingga, konsentrasi produk akan bertambah dan reaktan akan berkurang.
4. Topik: Stoikiometri
Sebanyak 300 mL larutan H2SO4 1 M digunakan untuk melarutkan 0,1 mol Al(OH)3 menghasilkan garam dan air. Tentukan massa garam sulfat (Mr = 342) yang dihasilkan..
A. 34,2 g
B. 17,1 g
C. 30,5 g
D. 150 g
E. 342 g
Jawban: B
Pembahasan :
∩ H2SO4 = 1 X 0,3 = 0,3 mol
| 3H2SO4 + | 2A1 (OH)3 | A12 (SO4 )3 + | 6h2O | |
| m | 0,3 mol | 0,1 mol | ||
| b | 23 x 0,1 = 0,15 mol | -0,1 mol | 12 x 0,1 = 0,05 | 62 x 0,1 = 0,3 |
| s | 0,15 mol | – | 0,05 mol | 0,3 mol |
Massa = mol x MR
= 0,05 x 342
= 17,1 gram
5. Topik: Ikatan Kimia
Apa perbedaan overlapping / tumpang tindih orbital elektron antara molekul H2 dan molekul F2 ?
A. H2 terbentuk ikatan sigma, F2 terbentuk ikatan pi
B. H2 terdapat tumpang-tindih antara dua orbital s, F2 terdapat tumpang-tindih antara ujung orbital p dan ujung orbital p yang lain
C. H2 terdapat tumpang-tindih antara dua orbital s, F2 terdapat tumpang-tindih antara sisi orbital p dan sisi orbital p yang lain
D. H2 terbentuk ikatan pi, F2 terbentuk ikatan sigma
E. Tumpang-tindih orbital pada H2 dan F2 terdiri dari orbital yang sama
Jawaban: B
Pembahasan:
H2 dan F2 sama-sama memiliki 1 ikatan \sigmaσ, namun tumpang-tindih dalam H2 tersusun antar dua orbital s, F2 tersusun antar dua ujung orbital p.
Baca Juga: Tips Mengerjakan Soal TPA/TPS Verbal SBMPTN
6. Topik: Ikatan Kovalen Kepolaran
Gas Oksigen merupakan molekul non polar, namun larut dalam air yang merupakan molekul polar. Mengapa hal ini bisa terjadi?
A. Molekul O2 mampu memiliki kutub akibat dipol sesaat
B. Molekul O2 mampu memiliki kutub akibat dipol terinduksi dari molekul air
C. Molekul O2 mampu memiliki kutub akibat dipol permanen
D. Molekul O2 mampu memiliki kutub akibat adanya ikatan hidrogen
E. Molekul O2 mampu memiliki kutub karena memiliki ion
Jawaban: B
Pembahasan:
Walaupun air merupakan molekul polar, air dapat melarutkan gas oksigen yang merupakan molekul non-polar. Mengapa? Karena terdapat interaksi antarmolekul dipol-dipol yang bersifat sesaat.
Jadi, molekul yang memiliki senyawa polar (dipol) dan molekul yang tidak memiliki senyawa (senyawa nonpolar) bisa membentuk gaya tarik-menarik yang disebut interaksi dipol-non dipol yang terjadi secara induksi.
Bagian ujung molekul dipol yang bermuatan positif dapat menginduksi molekul yang tidak memiliki senyawa sehingga bisa membentuk dipol sesaat (dipol sementara). Setelah itu, akan terjadi yang namanya ikatan antara molekul dipol dengan dipol sesaat tadi.
7. Topik: Termokimia
Perhatikan beberapa pernyataan berikut!
(1). Terjadi interaksi elektrostatik dan juga proton
(2). Partikel bergerak transisi ke sumbu x, y, dan z
(3). Antar partikel terjadi interaksi
(4). Terjadi tumbukan partikel dengan dinding wadah
Manakah pernyataan di atas yang menunjukkan energi dalam?
A. (1), (2), dan (3) benar
B. (1) dan (3) benar
C. (2) dan (4) benar
D. Jika hanya (4) yang benar
E. Jika semuanya benar
Jawaban: A
Pembahasan:
Energi dalam adalah energi yang dimiliki oleh suatu zat ataupun sistem yang juga dapat digolongkan menjadi energi kinetik atau energi potensial. Sementara itu, energi kinetik memiliki pengertian sebagai gerakan molekul-molekul sistem, dan bentuk energi lainnya yang tidak berhubungan dengan gerak disebut energi potensial.
Pada pilihan jawaban (1), (2), dan (3) menyatakan bahwa:
- Energi yang berhubungan dengan interaksi antar partikel, antar elektron, dan proton merupakan energi potensial
- Energi yang berhubungan dengan gerak partikel dan tumbukan merupakan energi kinetik
- Energi kinetik dan energi potensial merupakan energi dalam sistem
8. Topik: Sel Volta
A(s) | A2+(aq) || B2+(aq) | B(s)
Jika terdapat notasi sel volta seperti di atas, maka kesimpulan yang dapat diambil adalah…
A. Massa A logamnya akan semakin bertambah
B. Logam A akan bertindak sebagai elektroda positif
C. Logam B akan bertindak sebagai anoda
D. Elektron akan mengalir dari logam A menuju ke logam B
E. Konsentrasi A2+ akan semakin meningkat
Jawaban : D
Pembahasan:
Pada soal ini yang harus diingat adalah rumus dari notasi sel, yaitu:
Anoda | Hasil ion oksidasi || ion yang sudah tereduksi | katoda
Jika disandingkan dengan notasi sel yang ada pada soal, maka kesimpulan yang bisa diambil adalah:
- B2+ akan mengalami reduksi. Di mana reduksi ini akan mengubah B2+ menjadi B di katoda B. Makanya, elektron akan mengalir dari logam A ke logam B.
- Selain itu, A juga akan mengalami oksidasi yang mengubah A tersebut menjadi A2+ di anoda A.
Baca Juga: Reaksi Benzena dan Sifat Kimianya – Materi Kimia Kelas 12
9. Topik: Isomer Ruang
Obat alergik seperti parasetamol atau asetaminofen sangat populer digunakan untuk meredakan nyeri dan juga demam. Jika dilihat dari struktur parasetamol yang terdapat pada gambar di bawah ini, maka berapa jumlah isomer optis aktif dari senyawa parasetamol tersebut?
A. 5
B. 4
C. 3
D. 1
E. 2
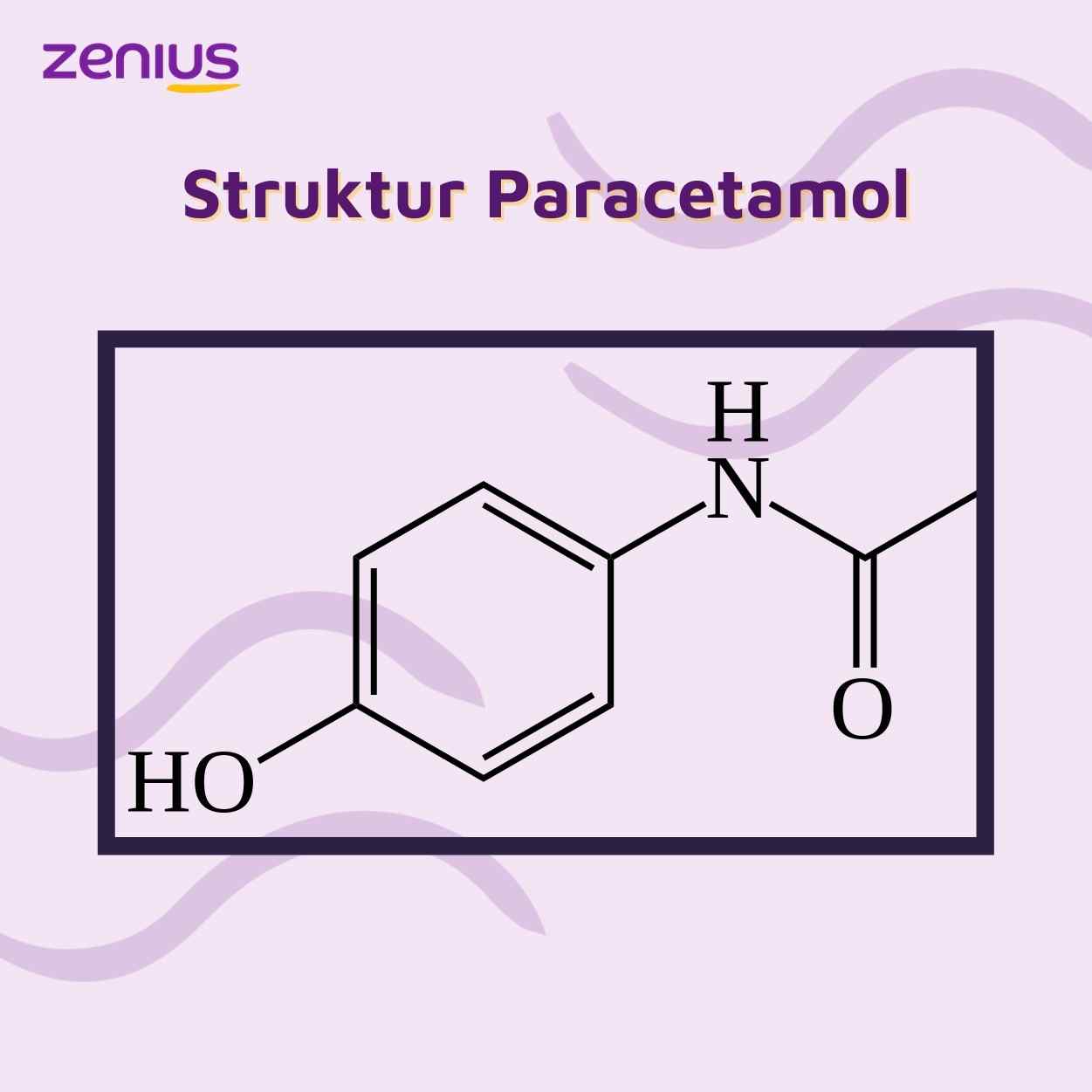
Jawaban: D
Pembahasan:
Isomer optis aktif adalah isomer yang dimana C-nya mengikat 4 atom. Di dalam struktur parasetamol tidak terdapat isomer optis yang aktif maka jawaban yang tepat adalah 1.
10. Topik: Reaksi Senyawa Karbon
Perhatikan beberapa reaksi kimia di bawah ini:
a. CH3– CH2 – OH CH2 = CH2 + H2O
b. CH3 – CH2 – CI + NH3 CH3 – CO – NH2 + HCI
c. CH3 = CH2 + HBr CH3 – CH2 – Br
Ke tiga reaksi tersebut dapat dinyatakan sebagai berikut:
- Reaksi a merupakan reaksi adisi
- Reaksi c merupakan reaksi dehidrasi
- Reaksi c merupakan reaksi eliminasi
- Reaksi b merupakan reaksi substitusi
Manakah pernyataan yang benar untuk reaksi di atas?
A. (1), (2), dan (3) benar
B. (1) dan (3) benar
C. (2) dan (4) benar
D. Jika hanya (4) yang benar
E. Jika semuanya benar
Jawaban: C
Pembahasan:
Pada reaksi a atau CH3– CH2 – OH CH2 = CH2 + H2O merupakan reaksi eliminasi atau perubahan dari ikatan tunggal menjadi rangkap/
Pada reaksi b CH3 – CH2 – CI + NH3 CH3 – CO – NH2 + HCI merupakan reaksi substitusi atau penggantian
Pada reaksi c CH3 = CH2 + HBr CH3 – CH2 – Br merupakan reaksi adisi atau perubahan ikatan rangkap menjadi ikatan tunggal.
Biar makin mantap buat menghadapi SIMAK UI, elo bisa coba ngetes kemampuan dengan mengikuti tes SIMAK UI yang diadakan di Zenius. Buruan klik banner di bawah ini!
Referensi:
Contoh Soal Simak UI – Zenius
Materi Belajar Kimia – Zenius
Contoh Soal Reaksi Senyawa Kimia – Zenius









Leave a Comment