Halo Sobat Zenius! Di artikel kali ini gue akan membahas bunyi hukum Lavoisier lengkap dengan contoh soalnya.
Tapi, elo tau gak sih siapa Lavoisier, dan sehebat apa dia sampe bisa punya hukum sendiri?
Jadi beliau ini adalah seorang ahli Kimia asal Prancis. Beliau ini juga menjadi orang di balik terciptanya revolusi Kimia pada abad ke-18.
Nah, salah satu penemuan spektakulernya di bidang Kimia adalah Hukum Kekekalan Energi atau nama lainnya Hukum Lavoisier.
Kalo elo penasaran bunyi hukum Lavoisier dan fungsinya terhadap perkembangan ilmu Kimia di dunia serta kehidupan sehari-hari, langsung aja simak artikel berikut ini ya.
Daftar Isi
Antoine-Laurent Lavoisier
Tapi sebelum gue membahas lebih jauh mengenai bunyi hukum Lavoisier dan contoh soalnya. Gak afdol nih kalo kita gak kenalan dulu dengan si “Bapak Kimia Modern” yang satu ini.
Sosok bernama lengkap Antoine-Laurent Lavoisier ini merupakan seorang ahli kimia yang lahir pada 26 Agustus 1743 dan wafat pada 8 Mei 1794 Paris, Prancis.

Dan elo tau gak sih Lavoisier ini bisa dibilang “the real” salah jurusan. Soalnya meskipun punya titel ahli Kimia. Lavoisier itu seorang lulusan hukum asal Collège Mazarin lho.
Keluarganya termasuk ke dalam kelompok sosial borjuis, dengan ayahnya sendiri adalah seorang pengacara. Tapi, sebenernya dari dulu Lavoisier lebih suka sama sains.
Makanya, setelah lulus dari fakultas hukum, ia memilih untuk mulai melakukan penelitian di bidang sains dan akhirnya bergabung dengan Academy of Sciences (komunitas filsuf alamiah di Paris) pada tahun 1768.
Sebuah buku berjudul Traité élémentaire de chimie yang dipublikasikan pada tahun 1789 menjadi pertanda dimulainya era baru dalam ilmu pengetahuan Kimia. Berbarengan dengan adanya peristiwa Revolusi Prancis.
Melalui karyanya tersebut, Lavoisier memaparkan hasil penemuannya mengenai proses respirasi dan pembakaran yang terjadi karena adanya reaksi kimia dengan zat yang ada di udara. Lavoisier menyebutkan bahwa oksigen berperan besar dalam proses pembakaran. Hasil penelitian itu pulalah yang menjadi landasan atas terbentuknya “Hukum Kekekalan Massa” atau yang sering kali disebut sebagai “Hukum Lavoisier“.
Bunyi Hukum Lavoisier
Nah, sekarang elo udah tahu kan latar belakang singkat Lavoisier, selanjutnya bunyi hukum Lavoisier atau Hukum Kekekalan Massa itu gimana sih?
Jadi bunyi hukum Lavoisier adalah sebagai berikut:
“Jumlah massa zat sebelum reaksi, sama dengan jumlah massa zat setelah reaksi.”
Lavoisier sampai pada kesimpulan tersebut atas hasil percobaannya membakar raksa.

Nah, ketika raksa tersebut dibakar, Lavoisier sempet kaget karena jumlah massa raksa tersebut bertambah dari jumlah massa ketika sebelum dibakar.
Kok bisa? Padahal kalau kita lihat kayu yang dibakar, massanya justru akan berkurang ketika sudah menjadi abu. Memangnya pembakaran itu akan membuat massanya berkurang atau bertambah?

Ternyata gini, seperti yang udah sempet gue singgung di awal, bahwa oksigen itu berperan penting dalam proses pembakaran. Ternyata, massa raksa tersebut bertambah karena adanya oksigen.
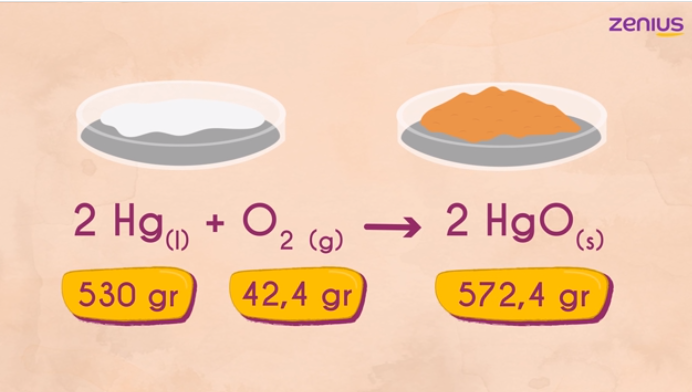
Kalau elo pakai contoh di atas, sebenernya bahkan sebelum terjadi pembakaran, jumlah massa raksa tersebut udah 572,4 gr. Yang luput dari perhitungan adalah keberadaan oksigen nih.
Lavoisier berhasil membuktikan keterlibatan oksigen di dalam reaksi pembakaran tersebut. Oleh karena itu, massa raksa sebelum dan sesudah pembakaran tetap sama.
Nah, setelah membaca penjelasan di atas, kira-kira kalo gue tanya nih massa zat sebelum dan sesudah reaksi sama adalah bunyi hukum apa? Udah tau kan jawabannya, Yup betul banget, hukum Lavoisier atau hukum kekekalan massa.
Contoh Soal Hukum Lavoisier
Nah, biar makin paham sama hukum Lavoisier, gue udah punya beberapa contoh soal hukum Lavoisier nih lengkap dengan pembahasannya, langsung cek di bawah ini ya:
Contoh Soal 1
Diketahui sebuah karbon dibakar dengan oksigen yang memiliki massa 30 gram. Pada akhir reaksi, masih ada karbon dengan massa 4 gram.
Hasil pembakaran tersebut menghasilkan karbon monoksida dengan massa 58 gram. Hitunglah berapa massa karbon tersebut pada awalnya?
Pembahasan:
a). Total massa zat-zat hasil reaksi = massa karbon reaksi + massa oksigen
58 gram = massa karbon reaksi + 30 gram
Massa karbon reaksi = 58 gram – 30 gram
Massa karbon reaksi = 28 gram.
b). Massa awal karbon = massa karbon reaksi + massa karbon sisa
Massa awal karbon = 28 gram + 4 gram
Massa awal karbon = 32 gram.
Jadi, massa awal karbon tersebut adalah 32 gram.
Contoh Soal 2
Diketahui sebuah reaksi antara gas nitrogen dan hidrogen sebagai berikut.
Gas nitrogen dengan massa 10 gram bereaksi sempurna dengan gas hidrogen dengan massa sejumlah X. Reaksi tersebut kemudian menghasilkan amonia dengan massa 18 gram. Berapakah massa gas hidrogen pada awal reaksi?
Pembahasan:
10 gram + X = 18 gram
X = 18 gram – 10 gram
X = 8 gram.
Jadi, massa gas hidrogen pada awal reaksi adalah sejumlah 8 gram.
Gimana? Ternyata gampang kan mengaplikasikan maksud dari bunyi hukum Lavoisier ke contoh soal?
Oke, segitu dulu pembahasan kali ini tentang Hukum Lavoisier atau Hukum Kekekalan Massa. Semoga artikel ini bisa bermanfaat dan bikin elo ketagihan belajar Kimia ya!
Oh iya, kalo elo mau belajar materi Kimia yang lain atau mau coba jawab contoh soal hukum Lavoisier yang lainnya, elo bisa banget ngegunain rangkuman dan bank soal yang udah Zenius siapkan.
Caranya gampang, langsung klik banner di bawah ini ya, terus ketikkan materi yang elo mau di kolom pencarian. Selamat belajar!
*****
Referensi & Link Video
Originally Published: September 13, 2021
Update by: Sabrina Mulia Rhamadanty









Leave a Comment