Halo Sobat Zenius! Elo yang lagi duduk di kelas 10 pasti lagi bingung, ya, soal materi sifat keperiodikan unsur? Nggak perlu khawatir lagi. Pasalnya, dalam artikel ini gue akan mengajak elo semua buat membahas secara lengkap satu per satu!
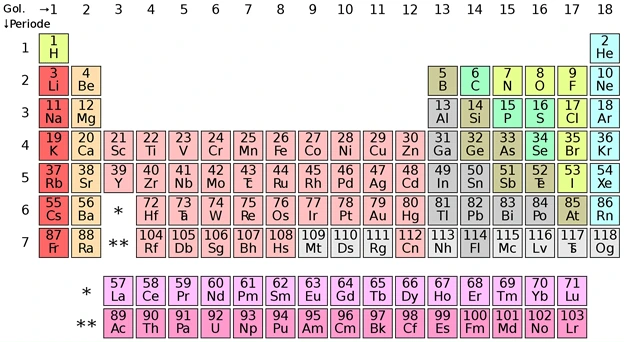
Elo pasti udah nggak asing, kan, sama tabel di atas? Bahkan, mungkin beberapa dari Sobat Zenius udah hafal?
Nah, di artikel ini kita bakal bahas sifat keperiodikan unsur, di mana ternyata sifat itu berhubungan erat dengan letak penempatan unsur tabel periodik di atas, lho.
Jadi, sebenarnya para ilmuwan nggak sembarangan menempatkan posisi setiap unsur periodik pada tabel tersebut.
Sifat yang akan dibahas dalam artikel ini adalah jari-jari atom, energi ionisasi, afinitas elektron, elektronegativitas, unsur logam dan non logam, keasaman, kereaktifan, serta titik leleh dan titik didih.
Biar Sobat Zenius lebih paham dan kenal sama sifat keperiodikan unsur, yuk, kepoin artikel ini sampai habis!
Daftar Isi
Jari jari Atom
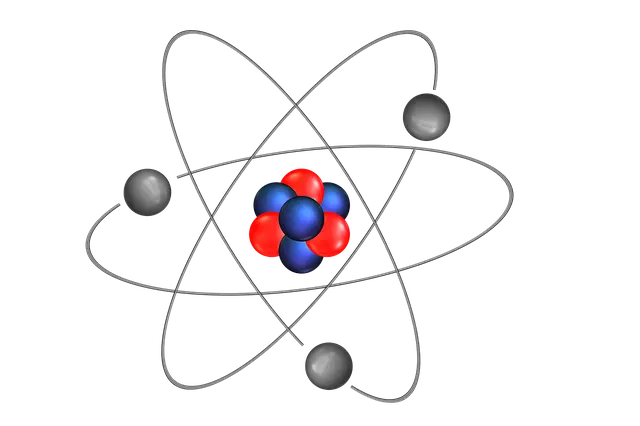
Sama halnya dengan jari-jari lingkaran yang selama ini kita pelajari dalam matematika, sifat periodik unsur yang satu ini merupakan jarak antara inti atom ke bagian terluar atom, atau kulit terluarnya.
Jari-jari atom memiliki kecenderungan sebagai berikut:
- Dalam satu golongan dari atas ke bawah jari-jari atom semakin besar dikarenakan semakin kebawah jumlah kulit atom akan semakin banyak.
- Dalam satu periode dari kiri ke kanan jari-jari atom semakin kecil, atau dapat dikatakan semakin ke kanan, akan semakin kecil dikarenakan muatan inti atom semakin banyak namun jumlah kulit tetap.
- Jari-jari ion positif (+) atau biasa kita sebut kation lebih kecil daripada atom netralnya.
- Berkebalikan dengan kation, jari-jari ion negatif (-) atau anion lebih besar daripada atom netralnya.
Sebelum masuk ke sifat periodik unsur selanjutnya, elo wajib download aplikasi Zenius dulu, nih!
Mengapa begitu? Pasalnya, lewat aplikasi elo bisa mengakses beragam video materi pembelajaran beserta fitur belajar lainnya seperti ZenCore, ZenBot, hingga simulasi ujian try out.
Menarik, kan? Yuk, download dari sekarang! Gratis!
Energi Ionisasi (Potensial Ionisasi)
Energi ionisasi adalah energi minimal atau energi yg diperlukan untuk melepaskan satu elektron pada atom netral dalam wujud gas. Sama halnya dengan jari-jari atom, sifat keperiodikan unsur yang satu ini juga memiliki kecenderungan sebagai berikut:
- Dalam satu golongan dari atas ke bawah, energi ionisasi suatu unsur semakin kecil dikarenakan jari-jari atom bertambah besar, sehingga daya tarik inti terhadap elektron terluar semakin lemah dan energi ionisasi berkurang.
- Dalam satu periode, energi ionisasi unsur bertambah dari kiri ke kanan karena jari-jari atom semakin kecil, sehingga daya tarik inti terhadap atom terluar semakin kuat dan energi ionisasi bertambah.
Namun, kecenderungan tersebut tidak berlaku pada unsur periode 3 seperti Mg (Magnesium), Al (Aluminium), P (Fosfor), dan S (Sulfur atau Belerang).
Afinitas Elektron
Afinitas Elektron adalah energi yang dilepaskan sebuah atom untuk menarik sebuah elektron. Sama halnya dengan sifat-sifat periodik unsur di atas, afinitas elektron juga memiliki kecenderungan sebagai berikut:
- Dalam suatu golongan dari atas ke bawah energi ionisasi semakin kecil, dikarenakan daya tarik inti terhadap elektron yang dilengkapi berkurang sehingga afinitas berkurang.
- Dalam suatu periode dari kiri ke kanan afinitas elektron semakin besar, dikarenakan daya tarik inti terhadap elektron yang ditangkap bertambah sehingga afinitas bertambah.
Elektronegativitas
Elektronegativitas atau sering disebut keelektronegatifan merupakan kecenderungan atau ukuran kemampuan suatu unsur untuk menarik elektron dan dalam membentuk ikatan ikatan, semakin besar keelektronegatifan maka suatu atom akan memiliki kecenderungan lebih tinggi dalam menarik elektron daripada atom yang lain.
- Dalam satu golongan, dari atas ke bawah maka keelektronegatifannya cenderung semakin berkurang.
- Dalam suatu periode, dari kiri ke kanan maka keelektronegatifannya cenderung semakin bertambah.
Sifat Logam dan Non Logam

Sifat kelogaman suatu unsur tergantung pada besarnya energi ionisasi, dan afinitas elektron. Berdasarkan sifatnya, dalam sifat keperiodikan unsur, unsur atau atom dapat dibagi menjadi 3, yaitu unsur logam dan non logam serta metalloid.
Lalu, apa saja sifat sifat dari unsur non logam, logam, dan metaloid? Simak tabelnya di bawah ini:

Kecenderungan sifat logam pada atom sebagai berikut
- Dalam satu golongan, dari atas ke bawah energi ionisasi semakin berkurang, sehingga semakin mudah melepas elektron dan sifat logam bertambah. Sedangkan untuk afinitas elektron dari atas ke bawah juga semakin berkurang sehingga semakin sulit untuk menangkap elektron maka sifat non logam berkurang.
- Dalam satu periode, dari kiri ke kanan energi ionisasi semakin bertambah, sehingga semakin sulit melepas elektron dan sifat logam berkurang. Sedangkan untuk afinitas elektron dari atas ke bawah juga semakin bertambah sehingga semakin mudah untuk menangkap elektron maka sifat non logam bertambah.
Keasaman dalam Sifat Keperiodikan Unsur
Merupakan sifat asam dan basa yang dimiliki suatu unsur periodik, di mana sifat asam berkaitan dengan unsur non logam, dan sifat basa berkaitan dengan unsur logam. Sifat asam dan basa suatu unsur memiliki kecenderungan sebagai berikut:
- Dalam suatu golongan unsur dari atas ke bawah, pada logam, akan sifat basa akan semakin meningkat, dan pada non logam, sifat asam akan semakin menurun.
- Dalam suatu periode dari kiri ke kanan, pada logam, sifat basa akan semakin menurun, dan pada non logam, sifat asam akan semakin meningkat.
Kereaktifan
Kereaktifan suatu unsur dipengaruhi oleh kemudahan unsur tersebut berikatan dengan unsur lain dan membentuk senyawa. Hal ini dapat dilakukan dengan dua cara yaitu dengan melepas atau menerima elektron, tergantung dengan kecenderungan dalam kemudahan dan kesulitan unsur tersebut menarik dan melepas elektron.
Untuk unsur yang bersifat logam, dalam suatu periode dari kiri ke kanan akan semakin kurang reaktif namun dalam suatu golongan dari atas ke bawah akan semakin reaktif.
Sedangkan untuk unsur bersifat non logam, dalam suatu periode dari kiri ke kanan akan semakin reaktif, namun dalam suatu golongan dari atas ke bawah akan semakin kurang reaktif.
Titik Leleh dan Titik Didih dalam Sifat Periodik Unsur
Titik leleh dan titik didih untuk unsur logam, ditentukan dari ikatan logam, sedangkan untuk unsur non logam ditentukan oleh gaya Van Der Waals, dan memiliki kecenderungan sebagai berikut
- Dalam suatu golongan, dari atas ke bawah, memiliki 2 jenis kecenderungan, dimana unsur dari golongan IA – IVA memiliki titik leleh dan didih yang semakin rendah, dan unsur dari golongan VA-VIIIA memiliki titik leleh dan didih yang semakin tinggi.
- Dalam suatu periode, dari kiri ke kanan, juga memiliki 2 jenis kecenderungan, dimana titik leleh dan titik didih semakin tinggi sampai dengan golongan IVA, dan kemudian turun drastis, menjadi titik leleh dan titik didih semakin rendah sampai dengan golongan VIIIA.
Kurang lebih itu, guys, sifat keperiodikan unsur yang wajib elo ketahui.
Semoga artikel ini dapat membantu kalian, ya, dalam mempelajari sifat sifat sistem periodik unsur.
Kalau Sobat Zenius mau liat materi mengenai sifat periodik unsur yang berupa video singkat serta latihan soalnya dan dijelasin oleh tutor Zenius langsung secara lengkap, elo bisa langsung klik gambar di bawah ini, ya. Selamat belajar!
Selain itu, buat Sobat Zenius yang mau belajar lewat contoh soal dan pembahasan dari mata pelajaran lainnya, elo bisa langsung berlangganan paket Aktiva Sekolah Zenius.
Selain contoh soal dan pembahasan, elo juga bakal mendapatkan benefit lainnya seperti ikut try out ujian sekolah hingga mengikuti sesi live class per minggu.
Tunggu apa lagi? Yuk berlangganan dari sekarang!
Baca Juga Artikel Kimia Lainnya
Larutan Elektrolit dan Non Elektrolit
Belajar Strategis Menghadapi UTBK Kimia
Originally published: January 8, 2021
Updated by: Maulana Adieb













Leave a Comment